
【题目】请根据装置图回答下列有关问题(K、K1、K2、K3为止水夹):
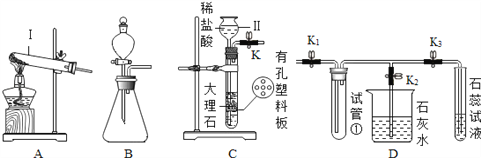
⑴写出图中标号仪器的名称:I________、II________。
⑵欲用过氧化氢溶液制氧气,可选用________发生装置(填“A”或“B”),请写出该反应的化学方程式________。
⑶C中发生的化学反应方程式为________。将C和D装置相连接能制备CO2并验证CO2的性质。连接C和D装置,关闭K2,打开K、K1、K3,用试管①收集CO2,此收集方法说明________。石蕊试液最终呈________色,使石蕊试液变色的微粒符号是________。
⑷关闭K3,打开K1、K2,烧杯中现象是________。
【答案】 试管 长颈漏斗 B 2H2O2 ![]() 2H2O+O2↑ CaCO3+2HCl==CaCl2+ H2O+ CO2↑ 二氧化碳密度大于空气 红 H+ 石灰水变浑浊
2H2O+O2↑ CaCO3+2HCl==CaCl2+ H2O+ CO2↑ 二氧化碳密度大于空气 红 H+ 石灰水变浑浊
【解析】本题主要考查了常用气体的装置的选取方法,要想解答好这类题目,就要熟记常用气体的发生装置和收集装置与选取方法及其依据,根据气体的制取原理来组装、选配、判断或者选择气体的发生装置;再根据气体的溶解性、密度及其是否与水或者空气发生反应等来判断、选用收集装置。
(1)由图示可知标号仪器是试管,Ⅱ是长颈漏斗;
(2)实验室用过氧化氢溶液制氧气,反应物的状态是固体和液体,反应条件是常温,应选用发生装置B,过氧化氢与二氧化锰混合生成物水和氧气,反应的方程式是:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(3)大理石(主要成分碳酸钙)与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为CaCO3+2HCl==CaCl2+ H2O+ CO2↑;用试管①收集CO2,是因为二氧化碳密度大于空气;二氧化碳与水反应生成了碳酸,碳酸是一种酸,能解离出氢离子,能使紫色石蕊试液呈红色,所以使石蕊试液变色的粒子符号是 H+;
(4)关闭K3,打开K1、K2,二氧化碳进入到烧杯中,二氧化碳能使澄清的石灰水变浑浊,所以烧杯中的现象是石灰水变浑浊。


科目:初中化学 来源: 题型:
【题目】某小组同学在用过氧化氢溶液与Mn02制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。为此,他们进行了如下探究:
(猜想与假设)
①速度慢、气泡少可能与过氧化氢溶液的浓度有关。
②速度慢、气泡少可能与Mn02的质量有关。
(进行实验)
根据图甲进行如下实验。
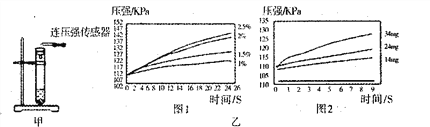
实验1:用26mg MnO2与5mL不同浓度过氧化氢溶液进行实验,压强变化如己图1。
实验2:用5mL 15%过氧化氢溶液与不同质量MnO2进行实验,压强变化如乙图2。
(解释与结论)
(l)过氧化氢溶液制取氧气的化学方程式为_________________。
(2)实验1得到的结论是___________。实验2的目的是___________ 欲得出“Mn02对过氧化氢分解有催化作用”的结论,需要对比_____________。(简要的写出实验设想)
(3)小组同学通过互联网得知:多种物质能催化过氧化氧的分解。
(实验探究)
实验证明,CuSO4溶液也能显著加快过氧化氢的分解,CuSO4溶液主要含有三种粒子(H2O、Cu2+、S042+),稀硫酸中含有三种粒子( H2O、H+、S042+)为了进一步探究CuSO4溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计。
①小组同学认为最不可能的是H20,他们的理由是___________________。
②要说明另外的两种粒子是否起到催化作用,小组同学设计了如下实验,完成探究活动。
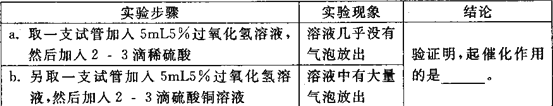 _____
_____
(反思与评价)
(4)小组同学在进行实验1和2制取氧气过程中,发现反应的速度很慢,产生的气泡很少的原因可能是_____________、______________。
(5)利用图甲装置探究“温度对过氧化氢分解速率”的影响,是否合理?_______理由是___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)请用化学符号填空:
①氮元素_______; ②天然气的主要成分__________;
③标出五氧化二磷中磷元素的化合价__________; ④铝离子结构示意图_______;
⑤3个氧气分子________; ⑥人体中含量最多的金属元素_________。
(2)①3H2O中表示分子个数的数字是________;
②S2- 中“2-”表示________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阿司匹林是治疗心血管病的重要药物之一,其主要成分是乙酰水杨酸(化学式为C9H8O4)。下列关于乙酰水杨酸的说法正确的是
A. 乙酰水杨酸分子中,碳原原子、氢原子和氧原子的原子个数比是12:1:16
B. 乙酰水杨酸中,碳元素与氧元素的质量比为9:8
C. 45g乙酰水杨酸中氢元素的质量是2g
D. 乙酰水杨酸中,氧元素的质量分数为![]() ×100%
×100%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验中经常用到一定溶质质量分数的溶液。
(1)实验室配制质量分数为4%的氯化钠溶液50g
①需要固体氯化钠的质量_____________g,水___________mL(水的密度1g∕cm3)
②用托盘天平称量所需的氯化钠钠时,移动好游码,向托盘中加入氯化钠,若指针偏向分度盘的左边,要进行的操作是_____________________。
(2)若用质量分数为6%的氯化钠溶液液(密密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液。
①需要6%的氯化钠溶液_________mL(计算结果保留一位小数),水________g。
②该溶液配制过程中除用到量筒、玻璃棒和烧杯外,还需要的仪器是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年平昌冬奥会闭幕式上,“北京八分钟”惊艳全球。在表演中,两只发光的大熊猫,受到全球瞩目。这是由四川省大木偶剧院制作的熊猫大木偶,如右图所示。回答下列问题。
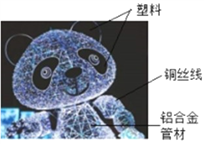
(1)图中标识的物质中,属于有机合成材料的是_______________,含有的金属元素是_______(填元素符号,写出一种即可);
(2)用铜丝做串联导线是利用其______ 性;
(3)选择铝合金做支架是利用其__________的特点;
(4)比较铝和铜的金属活动性强弱,请用化学方程式表示:_____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学将足量的锌粒加入到浓硫酸中,发现有大量的气泡放出,他们对气体的成分进行了探究。
【提出问题】锌粒加入浓硫酸后生成的气体是什么?
【查阅资料】
①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
【提出猜想】
甲:气体是H2;
乙:气体是SO2;
丙:气体是SO2和H2。
【实验探究】
为了验证上述猜想,同学们在老师的指导下设计了如下图的装置(部分夹持器材略去,假设每个能发生的反应都完全进行)进行探究:
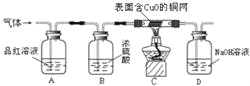
(1)实验开始后,观察到A中品红溶液褪色,证明气体中含有 。
(2)B装置的作用是 。
(3)C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是 ;加热一段时间后,观察到 ,证明气体中含有H2。
(4)写出D瓶中发生的反应的化学方程式 。
【讨论】
(1)锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么在反应过程中又产生了氢气呢?用文字简述原因: 。
(2)锌与浓硫酸和稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是 (任填一种合理的答案)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科。请结合下列实验装置回答问题。
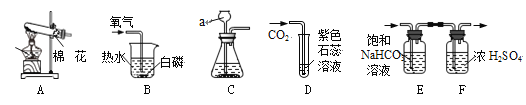
(1)写出图中所示实验仪器的名称:a_________________。
(2)写出A装置用高锰酸钾制取氧气的化学反应方程式________________。
(3)连接A、B装置,观察到B装置热水中的白磷燃烧,由白磷燃烧的事实说明燃烧需要的条件之一是________________。
(4)王刚同学利用C、D装置进行CO2的实验室制取、性质实验。D中观察到的实验现象为________________。
(5)实验C中产生的CO2常含有氯化氢气体和水蒸气,李静同学利用上图E、F装置除去杂质,得到纯净、干燥的CO2气体,E中饱和NaHCO3溶液的作用是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列图示的实验操作,回答问题:
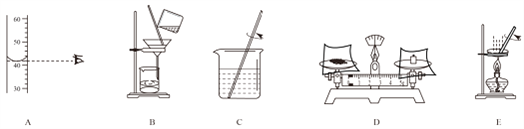
(1)若要完成“配制一定溶质质量分数的氯化钠溶液”的实验,主要进行的实验步骤依次 是计算、称量、量取、_____、装瓶贴签(填操作名称),现要配制 0.9%的氯化钠溶液 150g, 需要质量分数为 12%的氯化钠溶液(密度约为 1.09g/cm3)_____mL(计算结果精确到 0.1)。
(2)若要完成“粗盐中难溶性杂质的去除”的实验,如图中的操作步骤依次是_____(填操作序号),E 操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取_____等措施;若制得的精盐的产率偏高,则可能的原因是_____(填字母)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com