
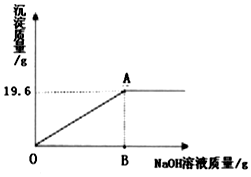
| A. | 20.58% | B. | 19.6% | C. | 98% | D. | 22.86% |
分析 根据镁和硫酸反应会生成硫酸镁和氢气,氧化镁和硫酸反应会生成硫酸镁和水,结合题中所给的数据进行分析解答.
解答 解:(1)设参加反应的镁的质量为x,硫酸质量为y,
Mg+H2SO4=MgSO4+H2↑
24 98 2
x y 0.2g
$\frac{24}{x}=\frac{98}{y}=\frac{2}{0.2g}$
x=2.4g,y=9.8g
(2)所以氧化镁的质量为:2.6g-2.4g=0.2g,
与氧化镁反应的硫酸质量为z,
MgO+H2SO4=MgSO4+H2O
40 98
0.2g z
$\frac{40}{98}=\frac{0.2g}{z}$
z=0.49g
故该稀硫酸的质量分数是:$\frac{9.8g+0.49g}{50g}×100%$=20.58%
故选:A.
点评 在解此类题时,首先分析题中的反应原理,然后结合题中所给的数据进行解答.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:初中化学 来源: 题型:实验探究题
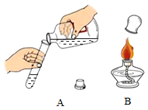 下列是化学实验中常见的基本操作.据图回答下列问题:
下列是化学实验中常见的基本操作.据图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 钙是维持人体正常功能所必需的元素,如图为某种补钙剂“钙尔奇”说明书的一部分
钙是维持人体正常功能所必需的元素,如图为某种补钙剂“钙尔奇”说明书的一部分查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
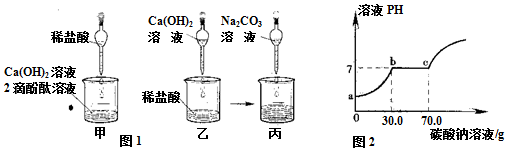
 有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动.
有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动. 查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蒸发5克水有晶体析出 | B. | 把温度降到0℃有晶体析出 | ||
| C. | 加入极少量的硝酸钾不溶 | D. | 以上三种方法都可以 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com