把4.7g氧化钾溶于95.3g水中.
(1)求所得溶液中溶质的质量分数;
(2)若使溶液的pH为7,需加入20%的硫酸溶液多少克?
【答案】
分析:(1)利用氧化钾与水反应的化学方程式和氧化钾的质量,列出比例式,就可计算出生成KOH的质量;然后根据溶质质量分数=
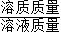
×100%计算即可;
(2)若使溶液的pH为7,就是把KOH完全中和.利用氢氧化钾与硫酸反应的化学方程式和(1)中计算出的KOH的质量,列出比例式,即可计算出把KOH完全中和需H
2SO
4的质量;然后根据“H
2SO
4的质量÷20%=硫酸溶液质量”计算即可.
解答:解:(1)设生成KOH的质量为x,
K
2O+H
2O=2KOH
94 112
4.7g x
∴94:4.7g=112:x,
解之得:x=5.6g;
所得溶液中溶质的质量分数为:
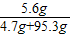
×100%=5.6%;
(2)设需硫酸的质量为y,
2KOH+H
2SO
4=K
2SO
4+2H
2O
112 98
6g y
∴112:5.6g=98:y,
解之得:y=4.9g;
所得硫酸的质量:
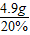
=24.5g.
答:(1)所得溶液中溶质的质量分数为5.6%;(2)所需硫酸溶液为24.5g.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

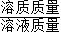 ×100%计算即可;
×100%计算即可;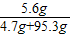 ×100%=5.6%;
×100%=5.6%;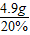 =24.5g.
=24.5g.
