
【题目】化学能帮助我们更好地认识物质世界、改善生活。
(1)创新发展材料技术可推动人类社会进步。
①石墨烯可用作太阳能电池的电极,这里主要利用了石墨烯的____性;
②2019年1月3日,嫦娥四号成功着陆在月球背面,所用的SiC颗粒增强铝基材料具有重量轻、高刚度、高耐磨、耐冲击等特点,该材料属于____(填字母);
a金属材料 b复合材料 c有机高分子材料
③高铁信息传输系统中使用的光导纤维,其主要成分是____(填字母);
a铜 b石墨 c二氧化硅
④基础工程建设中常用到水泥、玻璃、钢材等。钢材中添加铬、镍等元素的目的是__。
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量 | 营养成分 | 含量 | 营养成分 | 含量 |
水分 | 9.9 g | 淀粉 | 82.5 g | 蛋白质 | 4.8 g |
脂肪 | 0.2 g | 铁元素 | 1.10 mg | 钙元素 | 23.00 mg |
硒元素 | 0.02 mg | 其他 | …… |
①紫薯中能为人体提供能量的营养物质为脂肪、淀粉和____;
②以上营养成分中____(填元素符号)是人体中含有的微量元素,____(填元素符号)摄入不足,会导致骨质疏松、佝偻病;
③在酶的作用下,淀粉先水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式____。
【答案】导电性 b c 改变钢的内部结构,提高钢的抗腐蚀性能 蛋白质 Se、Fe Ca C6H12O6![]() 2C2H6O+2CO2↑
2C2H6O+2CO2↑
【解析】
(1)①石墨烯具有导电性,所以可用作太阳能电池的电极;
②SiC颗粒增强铝基材料是由不同种性能的材料复合而成的,属于复合材料;
③高铁信息传输系统中使用的光导纤维,其主要成分是二氧化硅;
④钢材中添加铬、镍等元素的目的是改变钢的内部结构,提高钢的抗腐蚀性能。故填:改变钢的内部结构,提高钢的抗腐蚀性能;
(2)①糖类、蛋白质与油脂是人体的供能物质,所以紫薯中能为人体提供能量的营养物质为脂肪、淀粉和蛋白质;
②铁和硒是人体所需的微量元素,钙元素属于人体所需的常量元素,人体缺乏钙元素易患佝偻病、骨质疏松;符号分别为:Se、Fe;Ca;
③在酶的作用下,葡萄糖再转化为乙醇和二氧化碳;化学方程式为:C6H12O6![]() 2C2H6O+2CO2↑。
2C2H6O+2CO2↑。


科目:初中化学 来源: 题型:
【题目】海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。

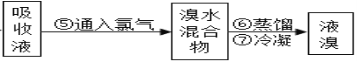
Ⅰ.从海水中获得氯化钠。将海水进行____________可得到粗盐;为除去粗盐中含有的硫酸钠、氯化钙、氯化镁等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液;③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是_______________。(用序号填一种合理组合),除去溶液中的硫酸钠发生反应的化学方程式为__________。
Ⅱ.(1)步骤②中的化学方程式为2NaBr+C12![]() 2NaCl+Br2,其反应基本类型_________。
2NaCl+Br2,其反应基本类型_________。
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr![]() 2KCl+Br2、Br2+2KI
2KCl+Br2、Br2+2KI![]() 2KBr+I2,由此可判断Cl2、I2、Br2活动性由强到弱顺序是_______。
2KBr+I2,由此可判断Cl2、I2、Br2活动性由强到弱顺序是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氮化镁是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物,制备特殊的陶瓷材料等.某兴趣小组用镁与氮气反应制备氮化镁(Mg3N2),并用实验方法测定氮化镁的纯度.
资料一:氮化镁是浅黄色粉末,极易与水反应生成氢氧化镁沉淀和氨气;
资料二:(NH4)2SO4+2NaNO2![]() 2N2↑+Na2SO4+4H2O,该反应为放热反应;
2N2↑+Na2SO4+4H2O,该反应为放热反应;
资料三:饱和硫酸亚铁溶液能吸收部分氧气;
资料四:在常温下或温度不高的条件下镁几乎与水不反应.
资料一:氮化镁是浅黄色粉末,极易与水反应生成氢氧化镁沉淀和氨气;
资料二:(NH4)2SO4+2NaNO2![]() 2N2↑+Na2SO4+4H2O,该反应为放热反应;
2N2↑+Na2SO4+4H2O,该反应为放热反应;
资料三:饱和硫酸亚铁溶液能吸收部分氧气;
资料四:在常温下或温度不高的条件下镁几乎与水不反应.
(制备氮化镁)制备氮化镁的装备示意图如图1:

(1)仪器a的名称是_____,b的名称是_____;
(2)D装置的作用是_____,G装置的作用是_____;能否将C、D装置对调_____(填“能”或“否”);
(3)写出E装置中发生反应的化学方程式_____;
(4)检查整套装置气密性的方法是_____;
(5)进行实验时先进行_____(选择“A”或“E”)处加热,理由是_____;
(6)A处加热片刻后,应移去酒精灯,理由是_____.
(测定氮化镁的含量)
(7)定性测定:
步骤一、取少量氮化镁样品于试管中,加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成;
步骤二、弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡.
①检验刺激性气味气体的方法是_____;
②写步骤二中产生气泡的反应的化学方程式:_____;
(8)定量测定:按如图2装置进行实验.
①球形干燥管的作用是_____;
②取氮化镁样品16克进行实验,I装置增重3.4克,求该样品中氮化镁的质量分数;_____
③导致该样品中氮化镁含量测定结果偏低的可能原因是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置图回答问题:
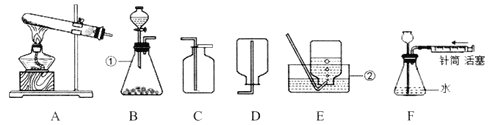
(1)写出标号仪器的名称:①_____,②_____。
(2)实验室用高锰酸钾制取氧气的化学方程式为_____;如用E装置收集氧气,当观察到_____时,再把导管口伸入盛满水的集气瓶里。
(3)乙炔(C2H2)是重要的化工原料。实验室用电石(CaC2块状固体)与水反应来制取乙炔气体,应选用的发生装置是_____。
(4)小明同学用B、C装置组合制取二氧化碳,当用燃着的小木条放在C装置瓶口时,发现小木条始终不熄灭,说明气体没有集满,可能的原因是_____。
(5)检查F装置气密性的方法是:当把针筒中的活塞内推后,静置观察,若看到_____,说明气密性良好。
(6)实验室用锌与浓盐酸反应制取纯净、干燥的氢气,可将制得的气体先通过盛有________的洗气瓶,再通过盛有_____的洗气瓶。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种不含结晶水的固体的溶解度曲线如图所示.下列说法中正确的是
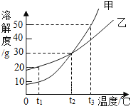
A. t3℃下质量相同的甲、乙饱和溶液分别降温至t2℃,析出的溶质质量相等
B. t2℃时,甲、乙饱和溶液溶质质量分数都为23.1%
C. t3℃时,甲的饱和溶液溶质与溶液的质量比为1:3
D. t1℃时,甲的溶解度大于乙的溶解度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后,现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法不正确的是
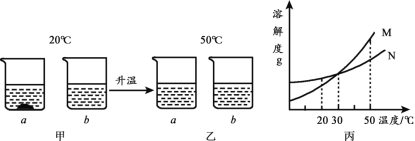
A. 图丙中M表示a的溶解度曲线 B. 图甲溶液中溶质的质量分数a大于b
C. 图乙溶液中b溶液一定不饱 和 D. 30℃时a、b溶解度相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )
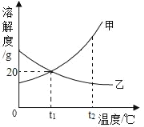
A. t1℃时,甲乙的溶解度相等,它们饱和溶液的溶质质量分数也相等,都为20%
B. t1℃时,30g甲加入到50g水中最多可得80g溶液
C. t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙
D. t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。

(1)烧杯中的溶液一定属于饱和溶液的是_______(填序号);
(2)图二能表示NaNO3溶解度曲线的是_________(填“甲”或“乙”);甲、乙两物质溶解度曲线的交点的含义是___________。
(3)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的_________(填序号)。
A 甲、乙都是饱和溶液 B 所含溶质质量:甲>乙 C 溶液质量:甲=乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】煅烧石灰石(主要成分 CaCO3)生成生石灰(CaO)和二氧化碳。为了测定某石灰石中碳酸钙(CaCO3)的含量,现称取 24.0g 石灰石样品,进行四次高温煅烧、冷却,称量剩余固体的质量 (杂质不参加反应),记录实验数据如下:
操作 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量 | 21.6g | 19.2g | 15.2g | 15.2g |
试计算:
(1)完全反应后生成二氧化碳的质量为_____;
(2)求该石灰石样品中碳酸钙的质量_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com