
| A. | 氧化铁 | B. | 碳酸钙 | C. | 碳酸钠 | D. | 硝酸钾 |
科目:初中化学 来源: 题型:计算题

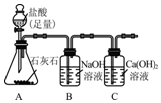
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
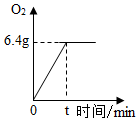 CuSO4是一种重要的化工原料,电解CuSO4溶液可制得O2等物质,发生的化学反应如下:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4,现取一定质量的溶质质量分数为10%的CuSO4溶液进行电解,当CuSO4完全反应时,停止通电,生成O2的质量与时间的关系如图所示,请计算:
CuSO4是一种重要的化工原料,电解CuSO4溶液可制得O2等物质,发生的化学反应如下:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4,现取一定质量的溶质质量分数为10%的CuSO4溶液进行电解,当CuSO4完全反应时,停止通电,生成O2的质量与时间的关系如图所示,请计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
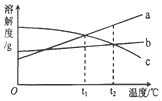 a、b、c 三种物质的溶解度曲线如图所示.取等质量t2℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是( )
a、b、c 三种物质的溶解度曲线如图所示.取等质量t2℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是( )| A. | 原饱和溶液中,溶质的质量分数 a>b=c | |
| B. | 恢复至 t2℃时,析出溶质的质量 a>b=c | |
| C. | 恢复至t2℃时,三种溶液一定都是饱和溶液 | |
| D. | 若继续降温至 t1℃,三种溶液一定都是饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
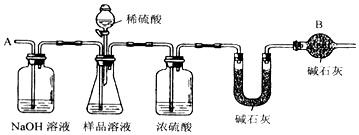
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁在氧气中燃烧,火星四射,生成红色固体 | |
| B. | 甲烷在空气中燃烧,产生蓝色火焰,生成二氧化碳和水 | |
| C. | 氢氧化钙溶液加入到碳酸钠溶液中,产生红褐色沉淀 | |
| D. | 一氧化碳通过灼热的氧化铁,红棕色固体变为黑色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com