

| 实验操作 | 实验现象和数据 | 结论 |
| ①准确称量洁净的铁丝和铜丝的质量 | 铁丝质量为ag, 铜丝质量为bg | \ |
| ②将铁丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铁丝质量为mg,(m<a),溶液有黄色变为浅绿色 | 一定有 生成(填化学式) |
| ③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铜丝质量为ng(n<b) | 铜 (填“能”或“不能”)与Fe2(SO4)3溶液反应 |
| ④另取相同质量、相同粗细的洁净铁丝和铜丝互相缠绕,插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、分别称量铁丝和铜丝的质量 | 铁丝质量较轻 铜丝质量不变 | Fe、Cu共存时 优先与Fe2(SO4)3溶液反应 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:初中化学 来源:不详 题型:单选题
| A.Z>Y>X | B.Y>X>Z | C.X>Y>Z | D.X>Z>Y |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 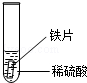 | 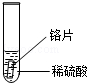 | 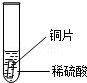 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 实验步骤 | 实验现象 | 结 论 |
| | | 金属活动性:Fe>Cu |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.Al>Ag>X | B.Ag>X>Al | C.Al>X>Ag | D.X>Al>Ag |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
 (2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为 ,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。
(2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为 ,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。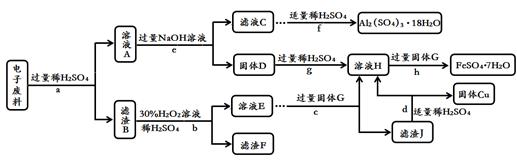
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
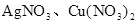 和
和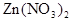 。为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如下方案进行实验:
。为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如下方案进行实验: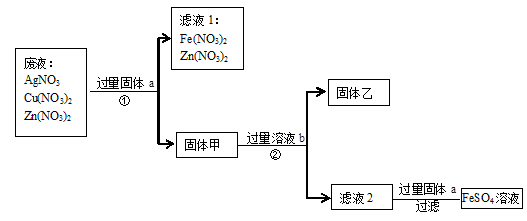
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com