
【题目】现有一固体混合物A的成分,已知其中可能含有NH4C1、Na2SO4、CuCl2、NaCl、AgCl几种物质中的两种或多种。按下图所示进行实验,出现的现象如下图中所述(设过程中所有可能发生的反应均恰好完全反应)。

试根据实验过程和发生的现象填写以下空白(均填写相应的化学符号):
(1)混合物A中,一定不存在的物质是_________,可能存在的物质是_________。
(2)气体B是_________,现象X为_________。
(3)滤液C中,存在的金属阳离子是_________。
(4)滤渣D是_________。
(5)写出实验过程③中发生的化学反应的化学方程式________。
【答案】 AgCl NaCl NH3 酚酞试液变红色 Na+ Cu(OH)2 BaCl2+Na2SO4=BaSO4↓+2NaCl
【解析】此题属于叙述实验型框图推断题,解题时,要紧跟实验步骤,抓住特征现象,比如:特征颜色、特征离子的检验等。在固体A中加入NaOH溶液,产生一种气体,将气体通入酚酞溶液中,有现象,结合白色固体中的物质成分,可判断含有NH4C1,气体B为氨气,在滤液C中加入BaCl2溶液,产生白色沉淀,可以判断原白色固体中一定含有Na2SO4,在滤渣D中加入稀硫酸,得到蓝色溶液,说明原白色固体中含有CuCl2。
解:(1)因为AgCl沉淀,且不溶于稀硫酸,所以混合物A中,一定不存在的物质是AgCl,可能存在的物质是:NaCl;
(2)经上面的分析,气体B是NH3,氨气溶于水形成氨水,呈碱性,所以现象X是:酚酞试液变红色;
(3)滤液C中,存在的金属阳离子是Na+;
(4)滤渣D是CuCl2与NaOH相互反应的生成物,是Cu(OH)2;
(5)实验过程③中发生的化学反应的化学方程式是;BaCl2+Na2SO4=BaSO4↓+2NaCl。


科目:初中化学 来源: 题型:
【题目】下列图象不能正确反映实验事实的是( )

A.向氢氧化钠溶液中滴加过量的稀盐酸
B.相同质量的锌粉和镁粉与等质量相同溶质质量分数的稀盐酸(足量)反应
C.加热氯酸钾和二氧化锰的混合物
D.向硫酸铜溶液中滴加氢氧化钠溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某气体既能用排水法收集,又能用向上排空气法收集,该气体具有的物理性质是( )
A.难溶于水,密度比空气大 B.难溶于水,密度比空气小
C.易溶于水,密度比空气大 D.易溶于水,密度比空气小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列事实中符合质量守恒定律的是( )
①蜡烛燃烧后,其质量变小;②铁丝燃烧后,生成物质量比铁丝的大了
③湿衣服晾干后,质量变小;④高锰酸钾受热分解后,剩余固体质量比原固体的减少
A.①②③ B.①②④ C.①②③④ D.只有③
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明按照课本实验(如图1)探究分子的运动时,闻到了刺激性的氨味.在老师的指导下,小明设计了如图2的实验装置,进行同样的实验,结果不再闻到刺激性的氨味,并立即观察到明显的实验现象,得到了和课本实验同样的结论.

【实验与结论】请你帮助小明完成图2装置的实验,回答下列问题.
(1)滴入少量浓氨水后,湿润的滴有酚酞溶液的滤纸条变成红色.从微观的角度分析,此现象说明_____________________________;从浓氨水化学性质的角度分析,此现象说明浓氨水呈________________.
(2)固体氢氧化钠的作用是__________________________________.
(3)与课本实验比较,小明改进后的装置的优点是(写出一点)______________________.
【继续探究】小英受小明实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的性质.
(4)打开活塞K滴入稀硫酸,两条用紫色石蕊溶液润湿的滤纸现象差别是________ 先变红。小英从课本实验中知道,二氧化碳和水本身都不能使石蕊溶液变色,因而她认为以上的现象差别验证的二氧化碳性质是____________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化,其图象如图所示,下列说法正确的是
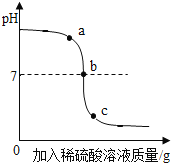
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C.该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量进行了如下的实验探究(假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
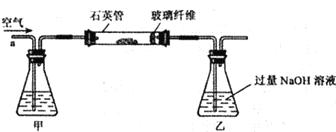
Ⅰ. 称取2.40 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
Ⅱ. 反应结束后,将乙瓶中的溶液进行如下处理:
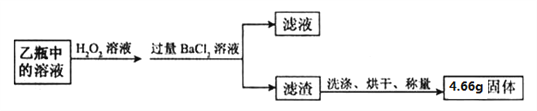
【问题讨论】
(1)Ⅰ装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是______________。
(2)Ⅰ装置中乙瓶内发生反应的化学反应方程式是____________________。
【含量测定】
(3)计算该黄铁矿中FeS2的质量分数__________________。(请写出计算过程)
【交流反思】
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会________________(填“偏大”“偏小”或“不变”)。
(5)Ⅱ中检验滤渣是否洗涤干净的方法是,取最后一次洗涤液,加入_____________,说明已洗涤干净。
【拓展应用】
工业上以黄铁矿为原料生产硫酸的工艺流程图如下所示:
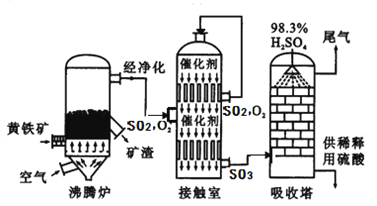
(6)接触室中发生反应的化学方程式为________________________。化学实验室常需要用到较稀的硫酸,把浓硫酸稀释的操作是_______________________________________,硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途______________________。
(7)依据生产硫酸的工艺流程图,下列说法正确的是_______________(填字母)。
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.沸腾炉排出的矿渣可供炼铁 D.吸收塔中为了提高吸收效率,采用喷淋的方式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com