
科目:初中化学 来源: 题型:阅读理解
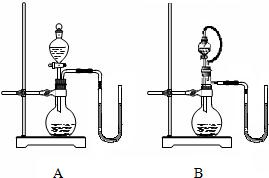 28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.
28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
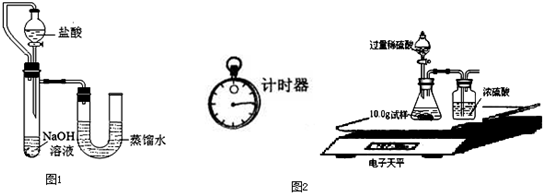
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
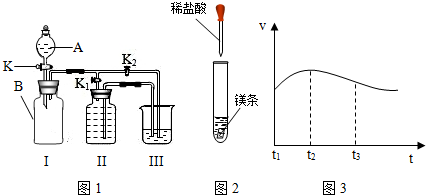
| ||
| ||
| 1 |
| 5 |
| 1 |
| 5 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较. 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较. |
pH>7 | CaCl2、Ca(OH)2 CaCl2、Ca(OH)2 |
pH≤7 pH≤7 |
CaCl2 |
| OH- | Cl- | SO42- | CO32- | |
| H+ | 溶、挥 | 溶 | 溶、挥 | |
| Ba2+ | 溶 | 溶 | 不溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 微溶 | 不溶 |
| Mg2+ | 不溶 | 溶 | 溶 | 微溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
| 稀盐酸与氢氧化钠溶液反应放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com