
分析 (1)根据锌和硫酸反应生成硫酸锌和氢气进行分析;
(2)根据参加反应的硫酸的质量和化学方程式进行计算;
(3)根据锌的质量和合金质量计算锌的含量;
(4)根据反应后溶质质量和溶液质量计算溶质质量分数;
(5)根据溶液稀释前后溶质质量不变进行分析.
解答 解:(1)锌和硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
(2)参加反应的硫酸质量为:100g×19.6%=19.6g,
设参加反应的锌的质量为x,生成硫酸锌的质量为y,生成氢气质量为z,
Zn+H2SO4═ZnSO4+H2↑;
65 98 161 2
x 19.6g y z
$\frac{65}{x}$=$\frac{98}{19.6g}$=$\frac{161}{y}$=$\frac{2}{z}$
x=13g
y=23.2g
z=0.4g
该合金中锌的含量为:$\frac{13g}{20g}$×100%=65%,
所以所得溶液溶质的质量分数为:$\frac{23.2g}{13g+100g+87.4g-0.4g}$×100%=16.1%,
需要98%的浓硫酸的质量是:$\frac{100g×19.6%}{98%}$=20g.
故答案为:(1)Zn+H2SO4═ZnSO4+H2↑;
(2)$\frac{65}{x}$=$\frac{98}{19.6g}$
(3)65%,
(4)16.1%,
(5)20g.
点评 本题主要考查化学方程式的书写和有关化学方程式的计算,结合数学图象解答,难度较大.注意:注意标明气体;计算要细心、准确.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气是一种宝贵的资源,其中氮气的含量为21% | |
| B. | 淡水资源占全球水储量的0.1%,我们要节约用水 | |
| C. | 地壳中氧元素含量最多 | |
| D. | 海洋不仅繁衍着无数的水生生物,还含有80多种化学物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④ | B. | ② | C. | ①②③ | D. | ①③ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
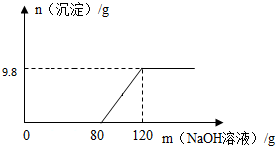 向盛有100g稀硫酸的烧杯中加入一定量的氧化铜粉末,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示.
向盛有100g稀硫酸的烧杯中加入一定量的氧化铜粉末,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
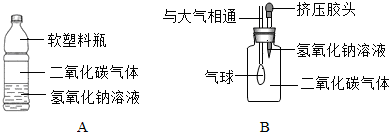
| 实验步骤 | 实验现象 | 实验结论 |
| 向B实验后的溶液中加入 稀盐酸(或氯化钙溶液等) | 有气泡产生(或有白色沉淀生成等) | 验证了二氧化碳和氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com