
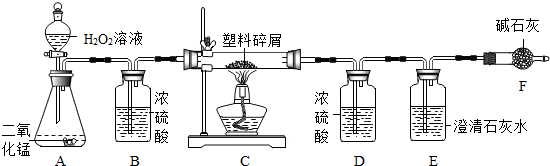
分析 塑料燃烧生成水和二氧化碳,二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水;
浓硫酸能够吸收水蒸气;
仪器D增重的质量即为反应生成水的质量,根据水的质量可以计算氢元素的质量.
解答 解:(1)仪器E中,二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,所发生的反应化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:Ca(OH)2+CO2═CaCO3↓+H2O.
(2)仪器B的作用是吸收水蒸气.
故填:吸收水蒸气.
(3)仪器D增重bg,说明反应生成了bg水,其中氢元素质量为:bg×$\frac{2}{18}$×100%=$\frac{b}{9}$g,则Wg该塑料试样中含氢元素的质量为$\frac{b}{9}$g,
故填:$\frac{b}{9}$.
(4)若装置中没有连接仪器B,将使水的质量偏大,从而导致该塑料试样中氢元素的质量测算结果偏大.
故填:偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 导体:石墨、铜丝、食盐水溶液 | B. | 盐类:烧碱、纯碱、小苏打 | ||
| C. | 混合物:合金、冰水共存物、碘酒 | D. | 非晶体:石蜡、海波、玻璃 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 切菜的刀钝了要磨一磨-为了减小压强 | |
| B. | 铝制品耐腐蚀-铝的化学性质稳定 | |
| C. | 揭开正在煮东西的锅盖时,会看到“白气”-气体的液化 | |
| D. | 煮粥时纯碱放多了加醋调节-发生了中和反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 操作步骤 | 判断依据 | 对应结论 |
| 把适量固体置于试管中,加入足量水溶解,再加入足量氯化钙溶液,静置后滴加酚酞试液 | 不产生沉淀,溶液变红色,或产生白色沉淀,溶液变红色,或产生白色沉淀,溶液不变色 | 氢氧化钠没有变质,或氢氧化钠部分变质,或氢氧化钠全部变质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验一 | 实验二 | 实验三 | |
| 实验 方案 | 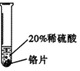 |  | 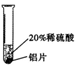 |
| 实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色. | 铜片无明显现象 | 铝片表面产生气泡较快. |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | 铝能和稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是铝、铬、铜 | |||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
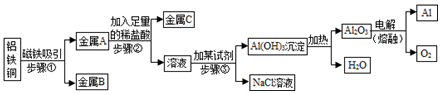
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
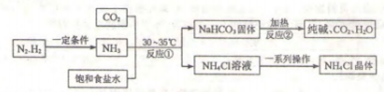
| 温度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - | |
| NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.5 | 77.3 | |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
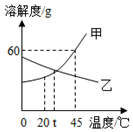 如图是甲、乙两种固体物质的溶解度曲线,请回答:
如图是甲、乙两种固体物质的溶解度曲线,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com