
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量的溶液与试管中, 滴加稀盐酸和碳酸钠溶液,滴加稀盐酸,或滴加碳酸钠溶液 | 无明显现象,或产生气泡,或产生白色沉淀 | 猜想1,或2,或3正确 |
分析 (1)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
(3)猜想1:如果碳酸钠和氯化钙恰好完全反应,滤液中的溶质是NaCl.
猜想2:如果碳酸钠过量,滤液中的溶质是NaCl和Na2CO3.
猜想3:如果氯化钙过量,滤液中的溶质是NaCl和CaCl2.
解答 解:(1)分别向A试管(装有碳酸钠粉末),B试管(装有碳酸钙粉末)中注入一定量的稀盐酸,两支试管内均观察到的现象是产生气泡;
A试管中碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:产生气泡;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)实验结束后,小组同学将A、B两试管中的废液倒入同一只烧杯中,发现烧杯中的废液变浑浊,说明过量的碳酸钠和反应生成的氯化钙反应生成了碳酸钙沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.
故填:Na2CO3+CaCl2═CaCO3↓+2NaCl.
(3)【提出猜想】
猜想1:滤液中的溶质是NaCl.
猜想2:滤液中的溶质是NaCl和Na2CO3.
猜想3:滤液中的溶质是NaCl和CaCl2.
故填:NaCl和CaCl2.
【设计实验】
向试管中滴加稀盐酸、碳酸钠溶液时,无明显现象,说明溶质是氯化钠;
向试管中滴加稀盐酸时,产生气泡,说明溶质是氯化钠和碳酸钠;
向试管中滴加碳酸钠溶液时,产生白色沉淀,说明溶质是氯化钠和氯化钙,实验过程如下表所示:
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量的溶液于试管中,滴加稀盐酸和碳酸钠溶液,滴加稀盐酸,或滴加碳酸钠溶液 | 无明显现象,或产生气泡,或产生白色沉淀 | 猜想1,或2,或3正确 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:初中化学 来源: 题型:填空题
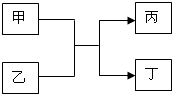 甲、乙、丙、丁是初中化学的常见物质,它们有如图的转化关系:
甲、乙、丙、丁是初中化学的常见物质,它们有如图的转化关系:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
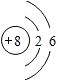 .
.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 暖贴的发热材料主要由铁粉、活性炭、食盐、水等物质构成.
暖贴的发热材料主要由铁粉、活性炭、食盐、水等物质构成.| 实验编号 | 实验药品及用量 | 反应时间 /min | 温度上升值/°C | ||||
| 铁粉/g | 活性炭/g | 食盐/g | 水/g | ||||
| 对照组 | 1 | 0.2 | 0.1 | 5 | 10 | 58 | |
| 实 验 组 | 1 | 0 | 0.2 | 0.1 | 5 | 10 | 0 |
| 2 | 1 | 0 | 0.1 | 5 | 10 | 2.7 | |
| 3 | 1 | 0.2 | 0.1 | 0 | 10 | 4.5 | |
| 4 | 10 | 20 | |||||
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
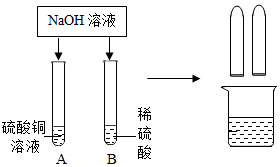 某化学小组在探究碱的化学性质时,做了如图所示的两个实验.
某化学小组在探究碱的化学性质时,做了如图所示的两个实验.| 实验内容 | 预计现象 | 预计结论 |
| (1)取少量滤液于试管中,观察 | 溶液呈无色 | 猜想甲不成立 |
| (2)继续在上述试管中加入硫酸铜溶液 | 产生蓝色沉淀 | 猜想丙成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1~2ml,滴入1~2滴无色酚酞试液,振荡 | 无色酚酞试液变红 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈中性或酸性 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 猜想 | 可行的实验方案 | 观察到的实验现象 |
| 猜想① | 将一小块果肉浸入盛有蒸馏水的烧杯中,观察现象. | 果肉表面不变色. |
| 猜想② | 将一小块果肉放入盛有氧气的集气瓶中,观察现象. | 果肉表面变色. |
| 猜想③ | 将一小块果肉放入盛有氮气的集气瓶中,观察现象. | 果肉表面不变色. |
| 猜想④ | 将一小块果肉放入盛有二氧化碳的集气瓶中,观察现象. | 果肉表面不变色. |
| 猜想⑤ | 将两块一样的果肉分别放入盛有氧气的集气瓶中,将其中的一个集气瓶放入热水中,观察现象 | 温度高的先变色. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com