
| A. | 块状大理石与硫酸混合 | B. | 蜡烛燃烧 | ||
| C. | 加热碱式碳酸铜 | D. | 大理石和稀盐酸混合 |
分析 实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.制二氧化碳药品的选择要考虑:是否容易获得气体;生成的气体是否连续;是否容易收集,是否节约能源;是否环保等.
解答 解:A、石灰石与稀硫酸反应生成的硫酸钙微溶于水,阻碍反应的进行,故选项错误;
B、蜡烛在氧气中燃烧,不好收集二氧化碳,选项错误;
C、加热碱式碳酸铜,需要的温度较高,不选用,故选项错误;
D、实验室制取CO2,是在常温下,用大理石的主要成分碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热,节约能源,故选项正确;
故选D.
点评 此题考查实验室制取气体,从原理是要注意以下几点:制得的气体要纯净,反应快,操作安全方便,便于收集等.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:初中化学 来源: 题型:选择题
| A. | 用带火星的木条探究吸入的空气和呼出气体氧气含量的不同 | |
| B. | 用铁丝代替红磷测定空气中氧气的含量 | |
| C. | 点燃蜡烛熄灭后产生的白烟,证明白烟具有可燃性 | |
| D. | 将集气瓶中的水换成细沙吸收硫燃烧生成的有害气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 |
| 加水的质量/g | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 14.5 | 8.1 | m | 6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
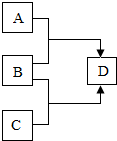 A、B、C、D为初中化学常见的物质,它们之间的转化关系如图所示(其中“→”表示转化关系).
A、B、C、D为初中化学常见的物质,它们之间的转化关系如图所示(其中“→”表示转化关系).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 氯气(Cl2)是黄绿色气体,氯气溶于水部分以Cl2分子存在于溶液中,部分与水反应Cl2+H2O=HCl+HClO.产物中,次氯酸HClO是一种弱酸.氯气溶于水所得溶液称为氯水.把品红试纸(染有品红颜料的滤纸)放入氯水中,品红试纸褪色.下图是实验室制取氯气的成套装置图,请填空:
氯气(Cl2)是黄绿色气体,氯气溶于水部分以Cl2分子存在于溶液中,部分与水反应Cl2+H2O=HCl+HClO.产物中,次氯酸HClO是一种弱酸.氯气溶于水所得溶液称为氯水.把品红试纸(染有品红颜料的滤纸)放入氯水中,品红试纸褪色.下图是实验室制取氯气的成套装置图,请填空:| 实 验 操 作 | 实 验 现 象 | 结 论 |
| ①把品红试纸放入水中 | (A)试纸不褪色 | 猜想1不成立 |
| ②把品红试纸放入干燥的氯气中 | 试纸不褪色 | 猜想2不成立 |
| ③把品红试纸放入盐酸溶液中 | 试纸不褪色 | 猜想3不成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在空气中燃烧发出微弱的淡蓝色火焰 | |
| B. | 细铁丝在氧气中点燃,剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 蜡烛在空气中燃烧产生大量白烟 | |
| D. | 红磷在氧气中燃烧,产生大量白烟 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
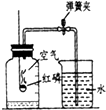 同学设计了测定空气中氧气含量的实验,装置如图.该同学的实验步骤如下:
同学设计了测定空气中氧气含量的实验,装置如图.该同学的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com