
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:(1)①氮元素的元素符号为:N;
②最简单的有机物是甲烷,其化学式为:CH4;
③离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故3个硫酸根离子可表示为:3SO42-;
④元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以二氧化氯中氯元素的化合价,故可表示为:$\stackrel{+4}{Cl}$O2;
(2)①可作干电池电极的是石墨;
②可用作补钙剂的是碳酸钙;
③用于中和土壤酸性的是熟石灰;
④厨房中用于洗涤油污中的“碱”是纯碱,即碳酸钠;
(3)①铁在氧气中燃烧燃烧,生成四氧化三铁,反应的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
②加热高锰酸钾能分解生成锰酸钾、二氧化锰和氧气,是一种物质生成三种物质的分解反应,故填:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
③绿色植物的光合作用反应的化学方程式为:6CO2+6H2O$\frac{\underline{\;\;\;光能\;\;\;}}{叶绿体}$C6H12O6+6O2;
④二氧化氮和铜加热生成氧化铜和一种空气中的主要气体,反应的化学方程式为:2NO2+4Cu$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+N2;
故答案为:(1)①N ②CH4 ③3SO42- ④$\stackrel{+4}{Cl}$O2(2)①B ②D ③A ④C
(3)①3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 ②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;③6CO2+6H2O$\frac{\underline{\;\;\;光能\;\;\;}}{叶绿体}$C6H12O6+6O2 ④2NO2+4Cu$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+N2
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K+、SO42-、OH- | B. | Cl-、K+、CO32- | C. | K+、Cu2+、NO3- | D. | Ba2+、SO42-、K+ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该混合液于试管中 加入氢氧化钠溶液,振荡,过滤, 用蒸馏水洗涤滤渣; ②取洗涤后的滤渣加入稀硝酸. | 有白色沉淀生成,加入硝酸后,沉淀溶解 | 得到硝酸镁溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
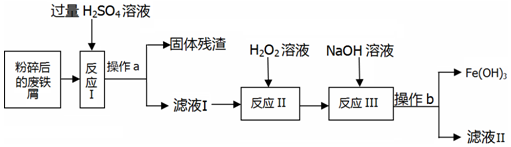
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 用甲醛溶液浸泡海产品保鲜 | B. | 用食醋除去暖水瓶中的少量水垢 | ||
| C. | 用熟石灰改良酸性土壤 | D. | 可用氢氧化钠治疗胃酸过多症 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
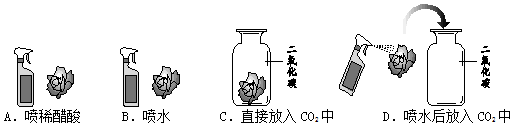
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
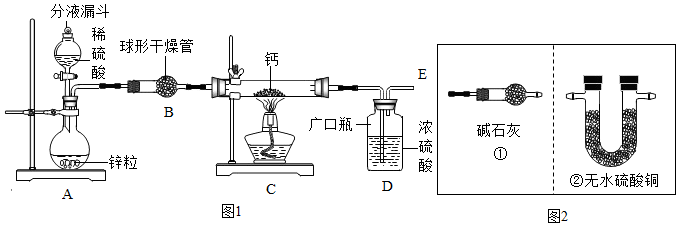
| 实验步骤 | 预期现象和结论 |
| 取少量固体样品,在干燥条件下与氧气反应,将 其产物通入装有无水硫酸铜的干燥管; | 若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙 |
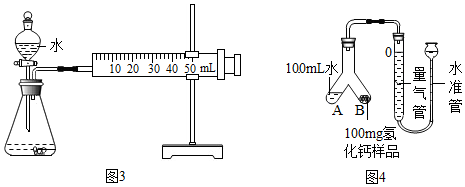
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水和溶液在生产、生活中起着十分重要的作用.
水和溶液在生产、生活中起着十分重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com