
【题目】如图是元素周期表的部分信息。
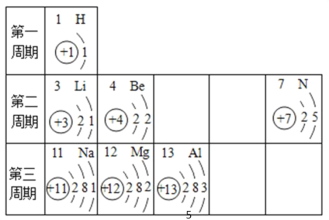
完成下列填空:
(1)H+核外电子数为_______;
(2)写出一条第三周期元素原子的核外电子排布规律_____________;
(3)第 7 号元素与第 12 号元素的原子形成化合物的化学式为_______________;
(4)X、Y、Z、W 元素表示 4 种物质,它们的微观示意图如图:
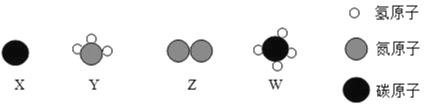
物质 X 和 Y 在高温和催化剂条件下反应生成 Z 和 W 两种物质,反应的化学方程式为________。
【答案】0 从左到右,最外层电子数逐渐增大 ![]()

【解析】
(1)氢原子核外只有一个电子,而H+是失去一个电子带一个单位的正电荷,则核外电子数为0;
(2)从图中分析,第三周期元素原子的核外电子排布规律是从左到右,最外层电子数逐渐增大;
(3)第 7 号元素是氮元素,原子最外层电子数为5,反应中易得到3个电子,常显-3价,第 12 号元素是镁元素,原子最外层电子数为2,反应中易失去2个电子,常显+2价,故由氮元素和镁元素形成化合物的化学式为![]() ;
;
(4)依据微观示意图分析,X是碳,Y是氨气,Z是氮气,W是甲烷,则物质 X 和 Y 在高温和催化剂条件下反应生成 Z 和 W 两种物质,反应的化学方程式为 。
。


科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学特有的思维方式.根据电解水的实验,回答下列问题.
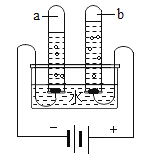
(1)从宏观上观察:如图所示,试管a和b中产生气体的体积比约为_____,b中产生的气体是_____(填化学式).
(2)从微观上分析:下列说法正确的是_____(填字母).
A.水是由氢气和氧气组成的
B.水是由氢原子和氧原子构成的
C.每个水分子是由2个氢原子和l个氧原子构成的.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为某一化学反应的微观示意图(X、Y、Z、W分别表示四种不同的物质)。
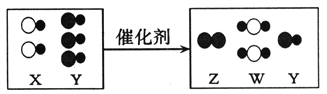
回答下列问题:
(1)该化学反应涉及的物质中,可能属于氧化物的有____________种;
(2)该反应的化学方程式可用X、Y、Z、W表示为____________________________;
(3)上图中某元素的粒子结构示意图为 ,其微粒符号可表示为A2-,则m的值为______________。
,其微粒符号可表示为A2-,则m的值为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向NaOH溶液中滴入稀H2SO4至恰好完全反应。
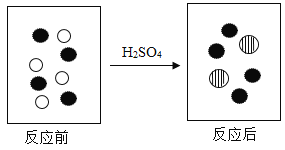
(1)写出反应的化学方程式:_______________。
(2)如图小球分别表示NaOH溶液与稀H2SO4反应前后溶液中溶质的粒子。写出下列小球代表的粒子符号:![]() ____________;
____________;![]() _____________。
_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等;镁还用来制造照相和光学仪器等;已知镁的原子序数是12,下列说法不正确的是 ( )
A.2Mg表示2个镁原子
B.Mg的原子结构示意图是: 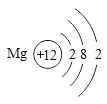
C.Mg在元素周期表中的位置是:第三行第二列
D.Mg在化学反应中易得到2个电子,变为正二价的镁离子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A. 碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3)g
B. 碳酸乙烯酯中C、H、O三种元素的质量比为12:1:16
C. 碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
D. 碳酸乙烯酯中碳元素的质量分数= ![]() ×100%
×100%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B 是初中学过的两种黑色物质,它们按下图所示进行实验,请根据图中物之间的相互转换关系。回答有关问题。
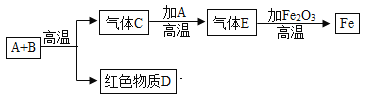
(1)写出下列物质的化学式:D__________;
(2)写出下列反应的方程式:
A+B→C+D_____________________;
E→ Fe __________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~E为初中化学常见的五种不同类别的物质,其中A是通常状况下密度最小的气体,C广泛应用于玻璃、造纸纺织和洗涤剂的生产。它们之间的关系如图所示(“﹣”表示相邻两种物质能发生反应;“→”表示两种物质间的转化关系;图中部分反应物、生成物及反应条件已略
去)。请回答下列问题:
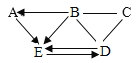
(1)C的化学式是_____。
(2)D的一种用途是_____。
(3)A→E的化学方程式是_____。
(4)B和D反应的基本反应类型是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图所示装置,回答问题。
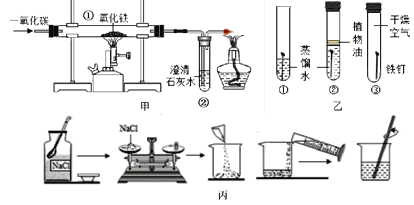
(1)甲实验中,实验前先通入CO的目的是__________,①处硬质玻璃管中反应的化学方程式为____________,②处试管内反应的化学方程式为___________________。
(2)乙实验中,哪支试管中的铁钉易生锈_______(填序号);写出一种生活中防止铁制品锈蚀的措施_____________________。
(3)丙实验中,配制50g质量分数为6%的氯化钠溶液,经计算,需称取氯化钠_______g,配制时应选用________mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水;若用俯视的方法量取所需的蒸馏水,所配制溶液的溶质质量分数_____________(选填“偏大”或“偏小”);溶解时用到玻璃棒,玻璃棒的作用为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com