
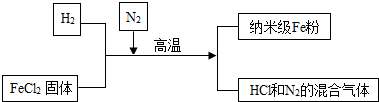
分析 (1)铁锈的主要成分是氧化铁,氧化铁能和稀盐酸反应生成氯化铁和水;
(2)①根据铁与氧气反应生成四氧化三铁考虑;
②根据反应前后各种原子种类和数目不变和氮气化学性质稳定考虑;
③根据铁不溶于水,氯化亚铁溶于水进行混合物的分离.
解答 解:(1)氧化铁能和稀盐酸反应生成氯化铁和水,反应的化学方程式分别为:Fe2O3+6HCl═2FeCl3+3H2O;
(2)①铁在氧气中燃烧生成四氧化三铁,所以黑色固体是四氧化三铁;
②反应物的分子中含有2个氢原子、一个铁原子、2个氯原子,生成物中已经含有一个铁原子,还缺少2个氢原子和2个氯原子,所以补充的内容是2HCl;氮气化学性质稳定,在反应中起保护气的作用;
③铁不溶于水,氯化亚铁溶于水,所以加水溶解,再进行过滤、洗涤干燥即可.
故答案为:(1)Fe2O3+6HCl═2FeCl3+3H2O;
(2)①Fe3O4;
②2HCl;
③水;过滤
点评 解答本题关键是知道铁燃烧的产物是四氧化三铁,能够灵活运用质量守恒定律解决实际问题,知道不溶性固体和液体分离的方法.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
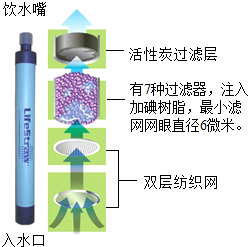 电视节目《荒野求生》中的生命吸管(如图所示)是一种将污水净化为饮用水的吸管装置,可以除去99.3% 的细菌和病毒,但难以除去汞等金属离子.回答下列问题:
电视节目《荒野求生》中的生命吸管(如图所示)是一种将污水净化为饮用水的吸管装置,可以除去99.3% 的细菌和病毒,但难以除去汞等金属离子.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H+、CO32-、Cl- | B. | Na+、Fe3+、OH- | C. | H+、K+、NO3- | D. | K+、Ba2+、SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 人体中缺乏维生素C,会患坏血病 | |
| B. | 炒菜的时候多加油盐,使菜有滋有味 | |
| C. | 用加碘盐作调味剂,可预防大脖子病 | |
| D. | 适量补充FeSO4,可预防缺铁性贫血 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | P是O2 Q是CO2 | B. | P是NaCl Q是NaNO3 | ||
| C. | P是Fe Q是Fe3O4 | D. | P是CO2 Q是CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
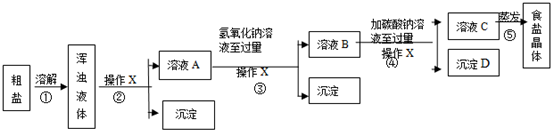
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示,是A、B、C三种固体物质的溶解度曲线.
如图所示,是A、B、C三种固体物质的溶解度曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com