
| 选项 | 物质(杂质) | 操作方法 |
| A | CO2(CO) | 将气体点燃 |
| B | CaO(CaCO3) | 加足量稀盐酸、过滤 |
| C | KNO3(NaCl) | 蒸发结晶、过滤 |
| D | FeCl2(CuCl2) | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误.
B、CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
C、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾溶解度受温度影响较大,而氯化钠受温度影响较小,所以可采取加热水溶解配成饱和溶液、冷却热饱和溶液使KNO3先结晶出来、再过滤的方法;故选项所采取的方法错误.
D、足量铁屑能与CuCl2溶液反应生成氯化亚铁溶液和铜,充分反应后过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
故选:D.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 点燃可燃性气体前,先检验气体的纯度,后点燃 | |
| B. | 用滴管吸取液体时,先捏扁胶头赶尽空气,再伸入瓶中吸液 | |
| C. | 制取氧气实验停止时,应先把导管移出水面,然后再熄灭酒精灯 | |
| D. | 启普发生器制氢气时,先向漏斗中注入稀硫酸,再往容器中加入锌粒 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
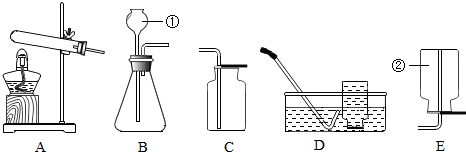
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g•cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
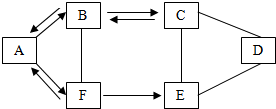 A~F为初中化学常见的六种纯净物,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,D可用于金属除锈,F是人体中含量最多的物质,B生成A的反应是自然界中最重要的反应.(图中“一”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,部分反应物或生成物及反应条件已略去).
A~F为初中化学常见的六种纯净物,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,D可用于金属除锈,F是人体中含量最多的物质,B生成A的反应是自然界中最重要的反应.(图中“一”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,部分反应物或生成物及反应条件已略去).查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
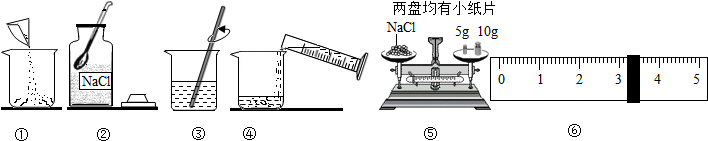
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 如图中的图1和图2是在打开K状态下的两种不同现象.(氯化氢易溶于水)
如图中的图1和图2是在打开K状态下的两种不同现象.(氯化氢易溶于水)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com