
| 物质 | CO | Fe2O3 | Fe | M | CO2 |
| 反应前质量(g) | 2.8 | 16 | 0 | 0 | 0 |
| 反应后质量(g) | 0 | 0 | 0 | a | b |
分析 (1)由赤铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
(2)
①根据碳与氧化铁的反应分析反应的现象;
②根据碳与氧化铁反应生成了四氧化三铁和二氧化碳写出反应的化学方程式.
③根据元素质量守恒和化学的意义分析计算回答.
解答 解:(1)设理论上可炼出含铁96%的生铁质量为x.
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
1000t×80% 96%x
$\frac{160}{1000t×80%}=\frac{112}{96%}$
x=583.3t.
(2)①由于碳与氧化铁在高温时反应生成了铁和二氧化碳,预期看到的实验现象应该是:红色固体变成黑色固体;
(2)CO还原Fe2O3时在一定条件下可生成Fe3O4和二氧化碳,发生的化学反应方程式是:3Fe2O3+CO$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2.
(3)设生成的二氧化碳的质量为x,由元素质量守恒可知:
CO~CO2
28 44
2.8g x
$\frac{28}{2.8g}=\frac{44}{x}$
x=4.4g
Fe2O3中铁元素的质量为16g×$\frac{56×2}{56×2+16×3}$×100%=11.2g
生成的M中氧元素的质量为:16g×$\frac{56×2}{56×2+16×3}$×100%-(4.4g-2.8g)=3.2g.
生成的M中铁原子、氧原子的个数比为:$\frac{\frac{11.2g}{56}}{\frac{3.2g}{16}}$=$\frac{1}{1}$
所以,物质M的化学式为FeO.
答案:
(1)理论上可以炼出含铁96%的生铁的质量为583.3t.
(2)①红色固体变成黑色固体;②3Fe2O3+CO$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2;③4.4;FeO.
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
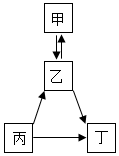 甲、乙、丙、丁均为初中化学常见物质且含有同一种元素,它们之间的部分转化关系如图所示(部分物质和反应条件已略去).
甲、乙、丙、丁均为初中化学常见物质且含有同一种元素,它们之间的部分转化关系如图所示(部分物质和反应条件已略去).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
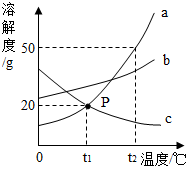 如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题:
如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 75% | B. | 80% | C. | 50% | D. | 25% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定有银生成 | B. | 所得溶液中一定有Cu2+ | ||
| C. | 一定有铜剩余 | D. | 一定有铁剩余 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 如图,A、B、C、D、E、F分别表示六种物质,A是目前世界年产量最高的金属,B物质溶于水后其溶液为蓝色,C是地壳中含量最高的金属元素组成的单质,D和E两种物质中不含相同种类的元素,E会造成温室效应,“
如图,A、B、C、D、E、F分别表示六种物质,A是目前世界年产量最高的金属,B物质溶于水后其溶液为蓝色,C是地壳中含量最高的金属元素组成的单质,D和E两种物质中不含相同种类的元素,E会造成温室效应,“ ”或“
”或“ ”表示两种物质之间能发生反应,“
”表示两种物质之间能发生反应,“ ”表示一种物质可以转化为另一种物质,部分反应物和生成物已略去,请回答下列问题:
”表示一种物质可以转化为另一种物质,部分反应物和生成物已略去,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com