
【题目】KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度 | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
(1)由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是______.
(2)10℃时,131g饱和KCl溶液,蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为______.
(3)如图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的______(填字母序号).
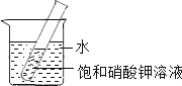
a.氢氧化钠固体 b.生石灰固体 c.硝酸铵固体
【答案】34.0g<x<37.0g 3.1g C
【解析】
(1)硝酸钾和氯化钾溶解度相同的温度是判断该段中溶解度的数值是否存在相等的可能,经分析知在20℃~30℃时这两种物质存在溶解度相同的可能。x的取值范围是34.0g<x<37.0g。
(2)10℃时,KCl的溶解度为31g,10g水中最多能溶解3.1g氯化钾。故蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为3.1g。
(3)因为硝酸钾的溶解度随温度升高而增大,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,说明硝酸钾的溶解度变小了,温度降低了,即该物质溶于水吸收热量,使温度降低,氢氧化钠固体、生石灰溶于水,都放出热量,使温度升高,所以都不行;硝酸铵溶于水吸热,会使溶液温度降低,故选C。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:初中化学 来源: 题型:
【题目】为测定某矿山开采的石灰石样品中碳酸钙的质量分数,进行下列操作:取6g石灰石样品,将其敲碎后,放入烧杯内(烧杯质量为20g),再加入50g足量的稀盐酸使其完全反应(杂质不与盐酸反应)。反应所需时间(t)和烧杯及其所盛物质总重量(m)的关系如图所示,试计算:
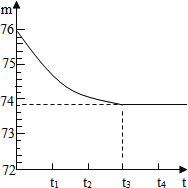
(1)实验结束时共放出二氧化碳______g;
(2)该石灰石样品中碳酸钙的质量分数________(计算结果保留小数点一位)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CO2 可用于制备碳酸饮料,人饮后有清凉感。某同学设计如下实验,测定某品牌碳酸饮料中的CO2 的含量。
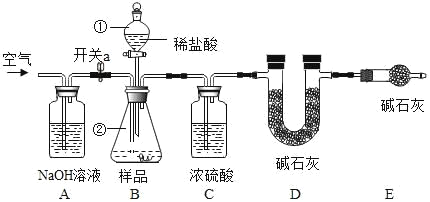
实验步骤:
①将 250mL 瓶装碳酸饮料放在冰箱中冷冻至刚好结冰;
②将饮料从冰箱内取出,迅速加入质量分数为 50%NaOH 溶液 5mL;倒转饮料瓶,轻轻震荡,完全反应,然后放置恢复至室温,待测定;
③称得装置 D 的质量为 x g,按上图连接实验装置。将步骤②中待测液全部加入仪器②中,关闭开关 a, 打开仪器①的活塞,向仪器②中注入稀盐酸,至不再产生气泡,关闭仪器①的活塞;
④打开开关 a,向装置中鼓入空气,一段时间后,称量 D 装置质量为 y g。
注:实验中各种溶液的密度都视为 1g/mL。碱石灰是 CaO 与 NaOH 的固体混合物。
(1)步骤②中发生反应的化学方程式为___________。
(2)E 装置的作用是_________。
(3)根据题中提供的数据计算此品牌碳酸饮料中 CO2 的含量为_____________g/L。
(4)步骤④鼓入空气的目的是___________。
(5)若没有 C 装置,则测得 CO2 含量会_____________(填“偏大”“偏小”“无法确定”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,增强环保意识,倡导垃圾分类,已逐渐被大众接受。某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图:
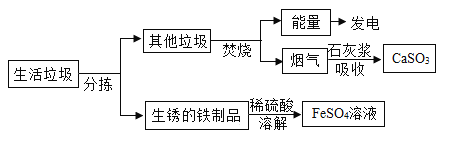
资料 1:垃圾焚烧产生的烟气中含有 SO2 等有害气体。
资料 2:FeSO4 容易被空气中的 O2 氧化。
回答下列问题:
(1)焚烧垃圾发电是将垃圾焚烧后产生的___________能转换为电能。
(2)石灰浆吸收 SO2(性质与 CO2 相似)的化学反应方程式为_____________。
(3)溶解步骤中同时发生的三个化学反应方程式为:Fe+Fe2(SO4)3=3FeSO4、____________________、___________________。
(4)将所得 FeSO4 溶液在氮气环境中蒸发浓缩、___________、过滤,得到 FeSO4 晶体,其中氮气的作用是_______。
(5)请你就东莞市生活垃圾处理提一条建议:____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】大规模利用电解水制取氢气,技术瓶颈是如何降低电能消耗,从而大幅降低制氢成本。如图甲是电解水的简易装置,图乙为电解水生成的气体体积与时间关系图,请回答完成下列问题:
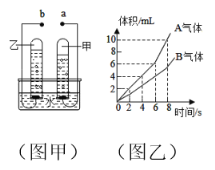
(1)在该实验中,通常会加入少量的硫酸钠或氢氧化钠的目的是________________。若甲管生成气体A,则b应接电源___极。
(2)若乙管生成气体B用带火星检验,产生的现象为_______,说明气体具有的性质为____。
(3)当4分钟后,甲、乙试管排出水的体积比为___。该反应的化学方程式表达式(为_________,该反应的基本类型为____________。
(4)该实验得出的一个结论为__________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠和硝酸钾两种固体的溶解度曲线如右图所示。下列说法正确的是
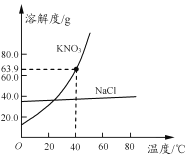
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0%
D.将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含 Y2O3 约 70%,含 Fe2O3、CuO、SiO2 等约30%)生产大颗粒氧化钇的种工艺如下:
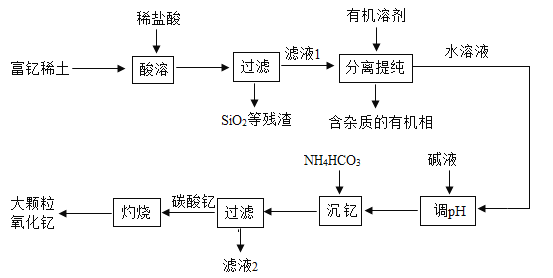
(1)氧化钇(Y2O3)中,Y 元素的化合价为____________。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是____________。
(3)“分离提纯”是为了除去滤液 1 中的___________(填化学式)。
(4)“调 pH”时加入碱液使溶液的 pH____________(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】该小组同学将一定量CO2分别通入澄清石灰水和氢氧化钠溶液中(如图所示),他们观察到前者变浑浊,后者无明显现象。
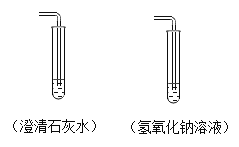
猜想:CO2和NaOH是否发生了化学反应?
实验:设计了甲、乙两个实验来验证CO2与NaOH发生了化学反应,如图所示。甲中现象为软塑料瓶变瘪,乙中现象“瓶吞鸡蛋”。
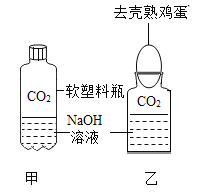
讨论:认为上述实验是可行的,其共同原理是____。但是有同学提出质疑,认为上述实验还不足以说明CO2和NaOH发生了反应。其理由是___。于是他们又补充了一个对照实验,这个实验是___;他们还发现将二氧化碳通入紫色石蕊溶液中,石蕊溶液变成红色,请用化学方程式说明原因_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )

A.t2℃时,甲、乙两种物质的饱和溶液分别蒸发水,析出的晶体质量甲大于乙
B.t2℃时,将50g甲加入50g水中,可以得到75g甲饱和溶液
C.等质量的甲、乙两物质的饱和溶液,从t2℃降温到t1℃时,甲溶液中溶剂质量一定大于乙溶液中溶剂质量
D.甲、乙两种物质的饱和溶液,从t1℃升高到t2℃时,所得溶液的溶质质量分数甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com