
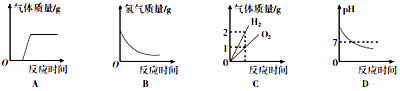
| A. | 向久置于空气中的NaOH溶液滴加盐酸 | |
| B. | 将锌块加入足量的稀硫酸中 | |
| C. | 电解水 | |
| D. | 向pH=9的NaOH溶液中不断加水 |
分析 A、氢氧化钠能和二氧化碳反应生成碳酸钠和水,氢氧化钠能和稀盐酸反应生成氯化钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
B、锌和稀硫酸反应生成硫酸锌和氢气;
C、电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2,质量比是8:1;
D、稀释氢氧化钠溶液时,溶液碱性减弱,pH减小.
解答 解:A、向久置于空气中的NaOH溶液滴加盐酸时,盐酸先和氢氧化钠反应生成氯化钠和水,后和碳酸钠反应生成氯化钠、水和二氧化碳,该选项对应关系正确;
B、锌和稀硫酸反应生成硫酸锌和氢气,随着反应进行,生成氢气质量增大,该选项对应关系不正确;
C、电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2,质量比是8:1,该选项对应关系不正确;
D、稀释氢氧化钠溶液时,溶液碱性减弱,pH减小,但是不能减小到7,更不能小于7,该选项对应关系不正确.
故选:A.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
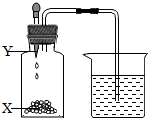 如图所示,烧杯内盛有水,瓶中X为固体,当把滴管内的液体Y滴入瓶中,烧杯内导管口一定没有气泡冒出的是 ( )
如图所示,烧杯内盛有水,瓶中X为固体,当把滴管内的液体Y滴入瓶中,烧杯内导管口一定没有气泡冒出的是 ( ) | A | B | C | D | |
| X | Na2CO3 | NH4NO3 | NaOH | Zn |
| Y | HCl | H2O | H2O | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
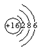 所表示的粒子符号为S,它的最外层电子数为6.
所表示的粒子符号为S,它的最外层电子数为6.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
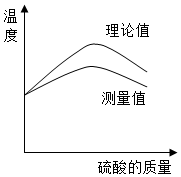 实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.
实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 | |
| 甲同学 | 取少量滤液于试管中,加入足量的碳酸钠溶液 | 产生白色沉淀 | 滤液中溶质的成分与猜想C对应 |
| 乙同学 | 取少量滤液于试管中,加入足量的Na2CO3溶液 | 无明显实验现象 | 滤液中溶质的成分与猜想A对应 |
| 实验操作及实验现象 | 实验结论 |
| 取少量滤液于试管中,滴加稀盐酸,有气泡产生 | 滤液中溶质的成分与猜想D对应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com