
如图所示的三个实验均可验证酸与碱能发生反应: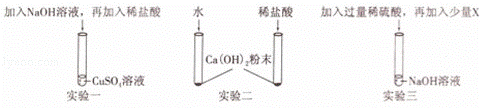
(1)根据实验一回答:
①加稀盐酸前,一定能观察到的实验现象是 ;
②该实验通过稀盐酸与 反应的现象,验证了酸与碱能发生反应.
(2)实验二通过两只试管中的现象对比,可以判断稀盐酸与Ca(OH)2能反应,该实验除需控制所加水和稀盐酸的温度、体积相同外,还需控制 相同.
(3)实验三中,加入X可验证稀硫酸与碱能发生反应,符合此条件的X是下列物质中的
A.酚酞 B.CuO C.Na2CO3 D.Ba(NO3)2.
| 中和反应及其应用;酸的化学性质;碱的化学性质. | |
| 专题: | 常见的酸 酸的通性. |
| 分析: | (1)据氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀分析;据实验现象推测结论; (2)据控制变量法分析; (3)据碱与酸的性质回答; |
| 解答: | 解:(1)氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀;据加入酸以后的氢氧化铜逐渐消失,溶液变为蓝色,推测酸与碱发生了化学反应; (2)由控制变量法分析,本实验中除了水和稀盐酸的种类不同外,其它各量必须保持相同,水和稀盐酸的温度、体积相同,还需控制 氢氧化钙粉末的质量相同. (3)在碱中加入过量的酸后,溶液显酸性,再加入酚酞后溶液仍为无色,说明碱已经不存在了,进而证明了酸与碱确实发生了反应; 故选A 故答案为:(1)产生蓝色沉淀,氢氧化铜;(2)氢氧化钙粉末的质量;(3)A |
| 点评: | 本题考查了酸碱的反应,有一定的难度,把握题中信息,做好分析即可. |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:初中化学 来源: 题型:
有一气体混合物含有二氧化碳、一氧化碳、氮气和水蒸气四种气体,现进行如下操作,请回答:(假设每步反应都进行完全)
(1)依次通过NaOH溶液、浓硫酸,此过程中发生反应的化学方程式为 _________ ;
(2)依次通过浓硫酸、炽热的氧化铁粉末,最后得到的气体有 _________ (填化学式)
查看答案和解析>>
科目:初中化学 来源: 题型:
下列有关实验操作的“先 ”与“后”的说法中,正确的是( )
”与“后”的说法中,正确的是( )
|
| A. | 制取气体时,先装药品,后检查装置的气密性 |
|
| B. | 用托盘天平称量10g固体药品时,先放砝码,后放药品 |
|
| C. | 用滴管取细口瓶内的液体时,先将其伸入液体内,后挤压取液 |
|
| D. | 加热KMnO4并用排水法收集O2的实验结束时,先熄灭酒精灯,后移出导管 |
查看答案和解析>>
科目:初中化学 来源: 题型:
请回答下列与木炭、氢气、一氧化碳有关的问题:
(1)其中理想的清洁、高能燃料是 ;
(2)点燃氢气和一氧化碳前都需要 ;
(3)在一定条件下,这三种物质都能与氧化铜反应生成铜,说明它们都具有 性.
查看答案和解析>>
科目:初中化学 来源: 题型:
关于各元素相对含量说法正确的是
| A.地壳中含量最高的元素是氧 | B.海洋中含量最高的元素是氯 |
| C.空气中含量最高的元素是碳 | D.人体中含量最多的元素是氢 |
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室获取氮气有很多种途径,常见的有3种方法。
方法一:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L。 进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)。
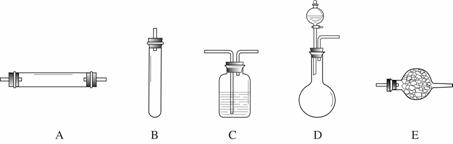
为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置 (选填装置编号)中加入 (填名称)以除去其它杂质气体。
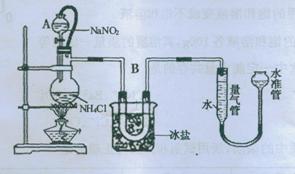
方法三:将亚硝酸钠(NaNO2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气。下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题。
【查阅资料】
(1)NaNO2+NH4Cl NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
 (此反应会放出大量的热);
(此反应会放出大量的热);
(2)B部分中冰盐是冷凝作用
【实验探究】
① ▲ ;
②20℃时,取含溶质0.21g饱和NH 4Cl溶液放入烧瓶,连接装置;
4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL;
④打开分液漏斗活塞 ,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】
(1)加入药品前必须进行的实验①是 ;
(2)步骤④中,移走酒精灯的目的是 ;
(3)计算生成氮气的质量和密度。 (4分,计算过程中以及最终数据均保留2位小数)
【解释与结论】
18 92年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件
92年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件 下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大)
下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大)
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
C
A.防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气
B.保证实验装置不漏气
C.使NaNO2饱和溶液顺利滴下 D.防止溶液冲入U形管
(2)科学家瑞 利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 .
利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 .
A.严谨求实的科学态度和敢于怀疑的批判精神
B.科学研究中遇到疑惑就趁早放弃,不要浪费时间
C.不能因为微小的差异而放过一次成功的机会
D.要相信权威,权威一定是正确的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com