
科目:初中化学 来源: 题型:
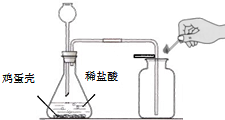 (2010?松江区一模)小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下实验探究.
(2010?松江区一模)小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下实验探究.| 至质量不减少 |
查看答案和解析>>
科目:初中化学 来源: 题型:
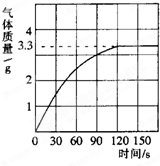 某校化学兴趣小组同学为了测定鸡蛋壳中碳酸钙的含量,将一定质量分数的稀盐酸逐滴加入到10.0g干燥的碎鸡蛋壳中,产生CO2气体的情况如图所示.当恰好完全反应时,消耗稀盐酸30.0g.求:
某校化学兴趣小组同学为了测定鸡蛋壳中碳酸钙的含量,将一定质量分数的稀盐酸逐滴加入到10.0g干燥的碎鸡蛋壳中,产生CO2气体的情况如图所示.当恰好完全反应时,消耗稀盐酸30.0g.求:查看答案和解析>>
科目:初中化学 来源: 题型:
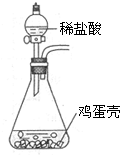 鸡蛋壳的主要成分是碳酸钙,为测定鸡蛋壳中的碳酸钙含量,某同学将鸡蛋壳洗净、充分干燥并捣碎,展开了下列探究.
鸡蛋壳的主要成分是碳酸钙,为测定鸡蛋壳中的碳酸钙含量,某同学将鸡蛋壳洗净、充分干燥并捣碎,展开了下列探究.| 反应前 | 鸡蛋壳的质量 | 16克 |
| 装置和稀盐酸的总质量 | 220克 | |
| 反应后 | 装置及其内容物的总质量 | 231.6克 |
查看答案和解析>>
科目:初中化学 来源:2012年湖南省怀化市芷江三中中考化学模拟试卷(一)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com