
分析 要使CO2与CO含有相同质量的碳元素,则碳原子的个数应相等,CO2和CO中碳原子个数相等,据此进行分析解答.
要使CO2与CO含有相同质量的氧元素,则氧原子的个数应相等,CO2和2CO中氧原子个数相等,据此进行分析解答.
根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答 解:要使CO2与CO含有相同质量的碳元素,则碳原子的个数应相等,CO2和CO中碳原子个数相等,则CO2与CO的质量比为44:28=11:7.
要使CO2与CO含有相同质量的氧元素,则氧原子的个数应相等,CO2和2CO中氧原子个数相等,则CO2与CO的质量比为44:(2×28)=11:14.
设CO2和CO的质量为m,则等质量的CO2和CO中所含氧元素的质量比是(m×$\frac{16×2}{44}$×100%):(m×$\frac{16}{12+16}$×100%)=14:11.
故答案为:11:7;11:14;14:11.
点评 本题有一定难度,抓住不同化学式之间的某些特征(如通式、原子个数之比和量的关系等),灵活巧妙地将它们进行变形转化,往往可以速解某些化学式计算型选择题.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
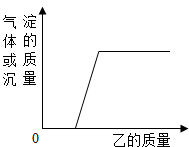 向下表中的甲物质中逐滴加入相应的乙溶液至过量.反应过程中产生的气体或沉淀的质量与加入乙的质量关系,不符合如图曲线描述的是( )
向下表中的甲物质中逐滴加入相应的乙溶液至过量.反应过程中产生的气体或沉淀的质量与加入乙的质量关系,不符合如图曲线描述的是( )| 序号 | 甲 | 乙 |
| 1 | 硝酸和硝酸镁的混合溶液 | 氢氧化钾溶液 |
| 2 | 铜和锌的合金 | 稀硫酸 |
| 3 | 久置空气中的铝片 | 稀盐酸 |
| 4 | 含有碳酸钠的氢氧化钠溶液 | 稀硝酸 |
| 5 | 盐酸和硫酸的混合溶液 | 硝酸钡溶液 |
| A. | 2、5 | B. | 1、3、4 | C. | 1、2、4 | D. | 1、3、5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 莽草酸中氢元素的质量分数最大 | B. | 莽草酸由碳、氢、氧三种元素组成 | ||
| C. | 莽草酸中各元素的质量比为7:10:5 | D. | 每个莽草酸分子里含有5个氢分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 组别 | 相同的铝片 | pH=3 的酸 | 反应片刻后添加的试剂(少量) | 添加试剂后的反应现象 |
| 1 | 1g铝片 | 5ml硝酸 | Na2SO4 | 无明显变化 |
| 2 | 1g铝片 | 5ml硝酸 | NaCl | 明显加快 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com