
| A. | NO 一氧化氮 | B. | Na2O 氧化钠 | C. | FeCl2 氯化铁 | D. | MgO氧化镁 |
分析 化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零.
解答 解:A、一氧化氮的化学式为:NO,故选项化学式与名称相匹配.
B、氧化钠中钠元素显+1价,氧元素显-2价,其化学式为Na2O,故选项化学式与名称相匹配.
C、氯化铁中铁元素显+3价,氯元素显-1价,其化学式为FeCl3,故选项化学式与名称不相匹配.
D、氧化镁中镁元素显+2价,氧元素显-2价,其化学式为:MgO,故选项化学式与名称相匹配.
故选:C.
点评 本题难度不大,掌握化合物化学式的书写一般规律(金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)是正确解答此类题的关键.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CO2(CO) | 足量O2 | 点燃 |
| B | CaO(CaCO3) | 适量稀盐酸 | 蒸发、结晶 |
| C | 硝酸钠溶液(硫酸钠) | 适量硝酸钡溶液 | 过滤 |
| D | Fe2O3粉(C粉) | 适量稀盐酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
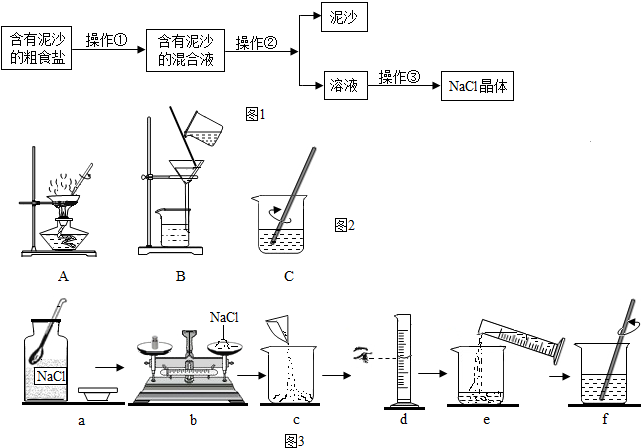
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
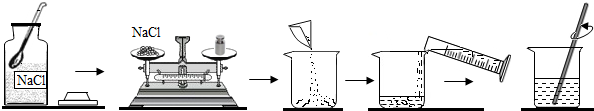
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
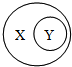 学习化学时可用右图表示某些从属关系,下列选项正确的是( )
学习化学时可用右图表示某些从属关系,下列选项正确的是( )| A | B | C | D | |
| X | 氧化物 | 纯净物 | 石油 | 氧化反应 |
| Y | 含氧化合物 | 单质 | 化石燃料 | 化合反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 浓度 时间(min) 催化剂 | 30%的H2O2溶液 | 15%的H2O2溶液 | 5%的H2O2溶液 |
| 加入wgMnO2 | 0.2 | 0.8 | 2.0 |
| 加入wgFe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com