
| ||
| 27×2 |
| 27×2+16×3 |
| ||
| 204 |
| 80%×x |
| 108 |
| 2160t |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
| A、蜡烛在空气中燃烧,发出红光,产生大量白色烟雾 |
| B、细铁丝在氧气中剧烈燃烧,火星四射,有黑色固体生成 |
| C、铜丝在空气中加热,红色的铜丝变成绿色 |
| D、木炭在氧气中燃烧比在空气中更旺,生成的气体可以让带火星的木条复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:
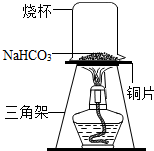 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 固体产物是Na2CO3,而不是NaOH | |
| 实验三: | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:
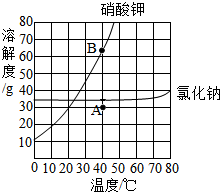 请根据如图所示的溶解度曲线,回答下列问题:
请根据如图所示的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
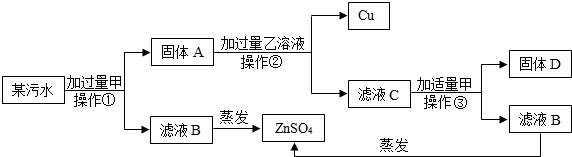
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
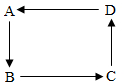 A、B、C、D为初中常见的物质,其中A为无色液体,D广泛用于玻璃、造纸、纺织和洗涤剂的生产.其转化关系如图所示(“→”表示转化关系,部分生成物及反应条件已略去).
A、B、C、D为初中常见的物质,其中A为无色液体,D广泛用于玻璃、造纸、纺织和洗涤剂的生产.其转化关系如图所示(“→”表示转化关系,部分生成物及反应条件已略去).查看答案和解析>>
科目:初中化学 来源: 题型:
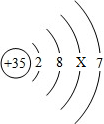 请根据如图所示在溴(Br)原子的结构示意图,回答下列问题:
请根据如图所示在溴(Br)原子的结构示意图,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com