解:(1)①集气瓶收集气体的仪器;
②如果用双氧水和二氧化锰制氧气就不需要加热,据发生装置特点可知是用双氧水制取氧气;
③氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;
④实验前,甲同学先向仪器A中加入水,然后将导管放入水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现的目的是:检查装置的气密性;
(2)Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变;
①氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃;
②为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论;
③过滤用到的仪器有:铁架台(带铁圈)、漏斗、烧杯、玻璃棒;
④过氧化氢能被CuO催化分解放出O
2,同时生成水,化学方程式为2H
2O
2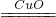
2H
2O+O
2↑;
故答案为:(1)①集气瓶;②H
2O
2;③向上排空气;④检查装置的气密性;
(2)Ⅲ、质量和化学性质不变;
①
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 剧烈反应,产生大量气泡 |
固体质量为0.2g |
带火星木条复燃 | |
②与步骤③对比,检验加入氧化铜后双氧水的分解速率是否发生了变化;
③玻璃棒;
④2H
2O
2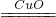
2H
2O+O
2↑.
分析:(1)①据常用仪器回答;
②制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热,据发生装置特点可知是用双氧水制取氧气;
③氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;
④实验前,甲同学先向仪器A中加入水,然后将导管放入水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现的目的是:检查装置的气密性;(2)Ⅲ、根据催化剂的定义回答;
①根据氧化铜对过氧化氢的分解有催化作用回答③现象;根据催化剂的定义和特点回答⑥结果;根据催化剂的定义和特点回答⑦现象;
②根据对比实验的探究方法回答;
③根据过滤所需的仪器回答;
④据反应原理书写方程式.
点评:本考点主要考查气体的制取和收集,同时也考查了催化剂的相关知识,综合性比较强,是考查的重点和热点,要根据相关知识细心分析解答.

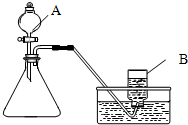 (1)甲同学选用如图1所示的装置制取氧气.
(1)甲同学选用如图1所示的装置制取氧气.
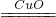 2H2O+O2↑;
2H2O+O2↑;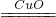 2H2O+O2↑.
2H2O+O2↑.

 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验. 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.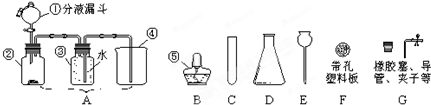
 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.