
【题目】实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2)制备碱式碳酸铜的主要实验流程如下。已知:二氧化硅不溶于水,也不溶于酸。
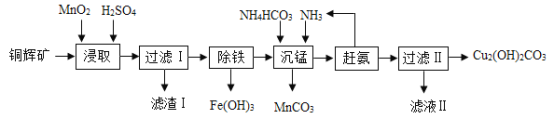
(1)浸取前辉铜矿粉碎成细颗粒,目的是________;
(2)硫酸浸取时,Cu2S被MnO2氧化的化学方程式为2MnO2 + Cu2S + 4H2SO4 = 2MnSO4 + 2CuSO4 +S+4______。滤渣Ⅰ的成分为MnO2、单质S和______(写化学式);
(3)浸取时,Fe2O3溶于硫酸反应的化学方程式为____;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是_____;
(4)沉锰时温度不宜过高,除了防止氨水挥发外,还能______;
(5)“赶氨”时,最适宜的操作方法是____,以减小氨气的溶解度;
(6)滤液Ⅱ中溶质主要是(NH4)2SO4,要得到其晶体可采用蒸发浓缩、______、过滤晾干;
(7)经过滤得到的产品碱式碳酸铜需要洗涤、烘干,其中洗涤的方法是向盛有碱式碳酸铜固体的过滤器中加入______,(填字母序号)重复几次即可洗净;
a Na2CO3溶液
b 蒸馏水
c 稀盐酸
(8)检验产品是否洗涤干净的方法:取最后一次洗涤液,__(①滴加稀盐酸、② 滴加Na2SO4 溶液、③ 滴加BaCl2溶液,填写序号),如果无明显的现象,说明已经洗涤干净。
【答案】增大接触面积,加快反应速率 H2O SiO2 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 铁离子在浸取时起催化作用 防止NH4HCO3分解 加热 降温结晶 b ③
【解析】
(1)浸取前辉铜矿粉碎成细颗粒,目的是增大接触面积,加快反应速率;
(2)由2MnO2+Cu2S+4H2SO4═2MnSO4+2CuSO4+S+4可知,反应前后锰原子都是2个,铜原子都是2个,硫原子都是5个,而反应前氢原子是8个,反应后应该是8个,氧原子反应前是20个,反应后应该是20个,因此4后面应该是由2个氢原子和1个氧原子构成的物质,该物质是水,化学式是H2O;滤渣Ⅰ的成分为MnO2、单质S和没有反应的SiO2;
(3)浸取时,Fe2O3溶于硫酸生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
研究发现若先除铁再浸取,反应速率明显变慢,其可能原因是铁离子在浸取时起催化作用;(4)沉锰温度不宜过高,除了防止氨水挥发外,还能防止NH4HCO3分解;
(5)因为气体的溶解度随着温度升高而减小,因此“赶氨”时,最适宜的操作方法是加热,以减小氨气的溶解度;
(6)滤液Ⅱ中溶质主要是(NH4)2SO4,得到其晶体可采用蒸发浓缩、降温结晶、过滤晾干;
(7)因为碱式碳酸铜不溶于水,经过滤得到的产品碱式碳酸铜需要洗涤、烘干,其中洗涤的方法是向盛有碱式碳酸铜固体的过滤器中加入蒸馏水;
(8)检验产品是否洗涤干净的方法:取最后一次洗涤液,滴加BaCl2溶液,如果无明显的现象,说明已经洗涤干净。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】以下是初中化学一些常见物质间互相转化的关系图(有些反应条件已省略):已知高温下CO能与多种金属氧化物反应生成相应的金属和CO2.下列关系图中A、B、X、Y均为无色气体,甲、乙、丙均为黑色固体,E、F为常见金属.

请回答:
(1)A的名称为___;蓝色溶液中溶质的化学式为___.
(2)生成固体甲的化学方程式为___.
(3)固体乙与丙反应的化学方程式为___.
(4)写出图中属于复分解反应的化学方程式___.
(5)固体乙与X的反应,说明X具有___性.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】肥料是农业生产中必不可少的,已知某氮肥溶液可能是氯化铵、碳酸铵、硫酸铵、尿素中的一种或几种,现要检验其成分,进行如下实验:
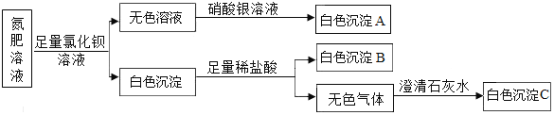
(1)写出产生沉淀C的化学方程式___________。
(2)通过以上实验分析,该氮肥溶液中一定含有哪些物质___________?
(3)选用哪种试剂代替氯化钡溶液,能检测出可能含有的一种氮肥是否存在___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我区某校同学在实验室制取气体并验证气体的某些性质.根据图回答问题.
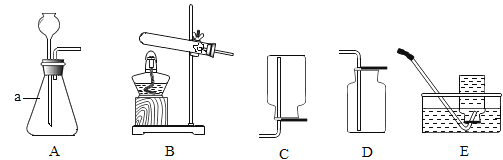
(1)写出仪器名称:a__.
(2)实验室用高锰酸钾制取氧气的化学方程式为__;若要收集较为干燥的氧气,可选用的收集装置是__(填字母).
(3)实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式__,可选用的发生装置是__(填字母).
(4)选用E装置收集气体时,下列实验操作正确的是__(选填数字编号).
①反应前,将集气瓶注满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
②开始反应后,看到有气泡冒出时,应立即将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有氧化镁、氢氧化镁和硫酸镁的混合物10克,加入100克9.8%的稀硫酸恰好完全反应,所得硫酸镁的质量可能是
A.12克B.16克C.17克D.18克
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如表列出了部分人体中含量较多元素的原子结构示意图.请回答下列问题.
H | O | Na | Mg | Cl | K | Ca |
|
|
|
|
|
|
|
(1)属于第四周期的元素是_____.
(2)钙元素的核电荷数是_____,若某种该原子的相对原子质量为40,则它的中子数为_____.
(3)一般来说,金属元素的原子最外层电子数目_____(填“<”、“=”或“>”)4个;钠、钾的化学性质有许多相似之处,其原因是_____.
(4)比较下列三种微粒的架构,找出相同点和不同点.
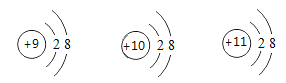
①相同点_____;(写出其中一点即可)
②不同点_____.(写出其中一点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化铵(NH4Cl)是重要的氮肥,硫酸钠(Na2SO4)是制造纸浆、染料稀释剂、医药品等的重要原料,根据Na2SO4和NH4Cl的溶解度曲线回答下列问题。
(1)下列措施中,不会使40℃的饱和硫酸钠溶液析出晶体的是(____)
A 蒸发溶剂 B 增加溶剂 C 降低温度 D 升高温度
(2)恒温蒸发70℃的饱和Na2SO4溶液,溶液的质量减少了29g,则析出Na2SO4固体的质量为_____g。
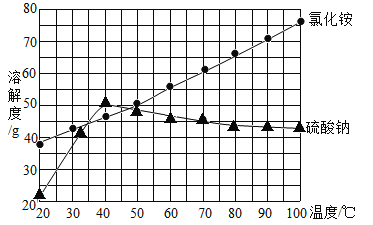
(3)70℃时,60gNH4Cl和40gNa2SO4完全溶解于100g蒸馏水中,冷却到40℃后,_____(填“有”或“没有”)NH4Cl析出,此时溶液质量分数NH4Cl_____(填“大于”或“小于”)Na2SO4。
(4)t2℃时,B物质的溶解度为40g/100g水,在150g水中投入_____g的B物质,溶液将达到饱和。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2.4H2O],煅烧可获得钛酸钡粉体。
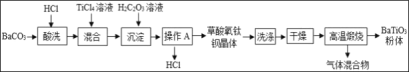
(1)BaTiO3中Ti元素的化合价是_____。
(2)“酸浸”过程中发生反应的化学方程式为_____。
(3)“操作A”的名称是_____。
(4)“绿色化学”理念提倡循环利用,流程中能循环使用的物质是_____。
(5)现有394kg BaCO3,理论上可以制备BaTiO3的质量为_____kg.( BaTiO3的相对分子质量为233,BaCO3的相对分子质量为197)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A﹣J为初中常见的化学物质,A、J是黑色固体,B、C、D、G为常见的气体,且C和D组成元素相同,H为紫红色固体,I溶液为浅绿色。转化关系如图所示,“→”表示物质间存在着转化关系(部分生成物、反应条件为标出),请根据所学的化学知识,回答下列问题。
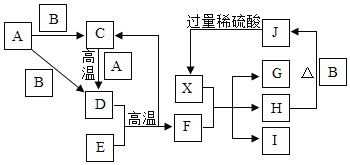
(1)写出物质的化学式:B_____,I_____;
(2)反应D+E![]() C+F是炼铁工业中的主要反应,写出化学方程式_____;该反应出现D的_____性(填一种化学性质),除D外,A﹣J物质中,还具备该性质的物质有_____(填物质化学式);
C+F是炼铁工业中的主要反应,写出化学方程式_____;该反应出现D的_____性(填一种化学性质),除D外,A﹣J物质中,还具备该性质的物质有_____(填物质化学式);
(3)生成紫红色固体H的化学方程式为_____属于_____反应(填基本反应类型);
(4)X是一种混合溶液,其溶质的成分有_____(填物质化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com