
23.04 g ![]() 和
和![]() 组成的固体混合物恰好和189.8g,10%的盐酸溶液反应,求所得溶液中溶质的质量是多少克?
组成的固体混合物恰好和189.8g,10%的盐酸溶液反应,求所得溶液中溶质的质量是多少克?
选题角度:通过分析的溶液的溶质的成分。
思路分析:此题涉及到四个反应:
![]()
![]()
![]()
![]()
由上面的方程式可以看出,最后所得溶液的溶质是![]() ,其中
,其中![]() 是由
是由![]() 、
、![]() 、
、![]() 和
和![]() 分别与
分别与![]() 反应转化而来的,而
反应转化而来的,而![]() 是由
是由![]() 提供的。根据反应前后元素的原子个数守恒,知每个
提供的。根据反应前后元素的原子个数守恒,知每个![]() 与2个
与2个![]() 的Cl原子相等。故有关系:
的Cl原子相等。故有关系:![]() 由此关系可求出溶质
由此关系可求出溶质![]() 的质量。
的质量。
设完全反应后生成![]() 的质量为
的质量为![]() 。
。
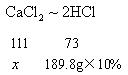
解得 ![]()
启示:由上可见,利用关系式解化学计算可起到化难为易、化繁为简的作用。解题过程中,最关键的一步是找到正确的关系式。如何找关系式呢?一般来说,有以下两条途径。
(1)利用元素的原子数守恒建立关系式;
(2)根据反应的化学方程式中各物质化学式前的系数进行递推,可找到反应物与生成物,反应物与反应物、生成物与生成物间的关系式。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | |
| 连续加入盐酸的体积/mL | 10 | 10 | 10 |
| 生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 连续加入盐酸的质量/g | 20 | 20 | 20 | 20 |
| 生成氢气的质量/g | 0.08 | 0.08 | 0.04 | ? |
查看答案和解析>>
科目:初中化学 来源: 题型:

| 合金的质量/g | 稀硫酸的体积/mL | 生成氢气的质量/g | |
| 第1次 | 2 | 15 | 0.04 |
| 第2次 | 2 | 20 | 0.04 |
| 第3次 | 4 | 15 | 0.04 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com