
| A. | 实验前,应先用砂纸打磨镁条至表面出现银白色 | |
| B. | 实验时,应使用石棉网 | |
| C. | 实验时,应用坩埚钳夹持镁条,在酒精灯上点燃 | |
| D. | 镁条在空气中缓慢燃烧,发出耀眼的白光,有大量黑烟生成 |
分析 A、根据镁是一种化学性质活泼的金属,在空气中常温下就能被缓慢氧化分析用砂纸打磨镁条的目的;
B、根据燃烧的产物温度较高产生的危害分析;
C、根据燃烧固体药品的方法分析;
D、根据镁燃烧的现象分析.
解答 解:A、镁是一种化学性质活泼的金属,在空气中常温下就能被缓慢氧化,因此用砂纸打磨镁条的目的是除去表面的氧化膜,便于镁条的燃烧,故正确;
B、镁条燃烧放出大量的热,生成物的温度较高掉落下来容易灼烧桌面,因此可以用石棉网承接,故正确;
C、燃烧镁条会放出大量的热,因此可以用坩埚钳夹持进行燃烧,故正确;
D、镁条燃烧会发出耀眼的强光,放出大量的热,生成白色固体,故现象描述错误;
故选:D.
点评 本题考查了镁的燃烧的现象的描述和实验的注意事项,化学实验是学习化学的基础,要熟练掌握实验现象的描述及特殊的实验的注意事项.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
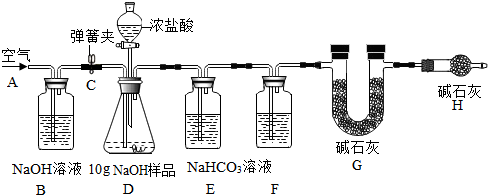
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
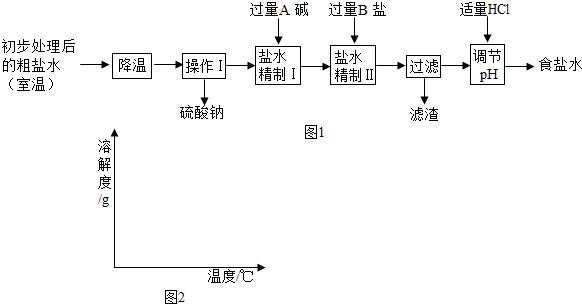
| 实验操作 | 实验现象 | 实验结论 |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是二氧化碳的知识网络图(反应条件已略).请用化学符号表示以下内容.
如图是二氧化碳的知识网络图(反应条件已略).请用化学符号表示以下内容.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 表示氧原子,
表示氧原子, 表示氢原子).试回答:
表示氢原子).试回答:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
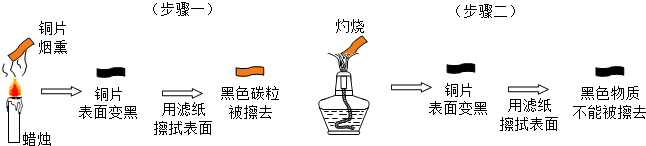
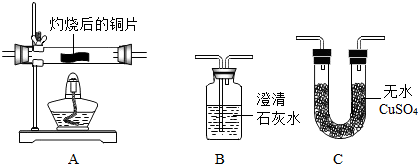
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com