
 实验室有一瓶未开封的浓盐酸,部分标签如图所示. 请回答下列问题.
实验室有一瓶未开封的浓盐酸,部分标签如图所示. 请回答下列问题.分析 (1)根据题意,这瓶浓盐酸密度为1.18g/cm3,体积为500mL,据此进行分析解答.
(2)根据溶液稀释前后溶质的质量不变,结合溶质质量=溶液质量×溶质的质量分数,进行分析解答.
(3)稀释后的盐酸溶液65.7g与10g含碳酸钙90%的石灰石恰好完全反应,由参加反应的石灰石的质量、碳酸钙的质量分数(或由参加反应的稀盐酸的质量、溶质的质量分数),由反应的化学方程式列式计算出生成氯化钙和质量、生成二氧化碳的质量,进而计算出生成物中溶质的质量分数即可,
解答 解:(1)这瓶浓盐酸密度为1.18g/cm3,体积为500mL(500cm3),这瓶浓盐酸溶液的质量是1.18g/cm3×500cm3=590g.
(2)若用这瓶浓盐酸来配制200g溶质的质量分数为10%的稀盐酸,设要取浓盐酸的质量是x,由溶液稀释前后溶质的质量不变,
则200g×10%=x×37% x≈54.1g.
(3)设生成氯化钙和质量为x,生成二氧化碳的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
10g×90% x y
$\frac{100}{111}=\frac{10g×90%}{x}$ x=9.99g
$\frac{100}{44}=\frac{10g×90%}{y}$ y=3.96g
生成物中溶质的质量分数为$\frac{9.99g}{65.7g+10g×90%-3.96g}$×100%≈14.1%.
答:(1)590;(2)54.1;(3)生成物中溶质的质量分数为14.1%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:初中化学 来源: 题型:解答题
 在紧张的学习生活中,一份美味的营养午餐不仅能为我们补充能量,也能带来好心情.右图是一份营养餐,包含了排骨、胡萝卜、玉米、西兰花、鸡蛋、米饭等食物.其中排骨和鸡蛋主要为人体提供的营养素是(1)蛋白质胡萝卜、西兰花富含的营养素对人体的作用是(2)调节新陈代谢、预防疾病、维持身体健康,玉米富含的营养素在人体内经(3)酶的催化作用,与(4)水发生一系列反应,最终变成(5)C6H12O6(填化学式).为了促进玉米的生长有时需要施加适量钾肥,请写出一种钾肥的化学式(6)KCl.该化肥 作用是保证(7)各种代谢过程的顺利进行,增强植物的(8)抗病虫害、抗倒伏能力.
在紧张的学习生活中,一份美味的营养午餐不仅能为我们补充能量,也能带来好心情.右图是一份营养餐,包含了排骨、胡萝卜、玉米、西兰花、鸡蛋、米饭等食物.其中排骨和鸡蛋主要为人体提供的营养素是(1)蛋白质胡萝卜、西兰花富含的营养素对人体的作用是(2)调节新陈代谢、预防疾病、维持身体健康,玉米富含的营养素在人体内经(3)酶的催化作用,与(4)水发生一系列反应,最终变成(5)C6H12O6(填化学式).为了促进玉米的生长有时需要施加适量钾肥,请写出一种钾肥的化学式(6)KCl.该化肥 作用是保证(7)各种代谢过程的顺利进行,增强植物的(8)抗病虫害、抗倒伏能力.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量(g) | 56 | 18 | 2 | 0 |
| 反应后的质量(g) | 10 | 0 | 2 | X |
| A. | x为64 | B. | 该反应为分解反应 | ||
| C. | 参加反应的甲物质的质量为46g | D. | 丙物质可能为催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 物质的溶解通常都伴随着能量的变化 | |
| B. | 溶质可以是固体,也可以不是 | |
| C. | 均一、稳定的液体一定是溶液 | |
| D. | 泥水中,泥是溶质,水是溶剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定稀硫酸的pH | |
| B. | 用干燥的pH试纸测定二氧化碳气体的pH | |
| C. | 把浓硫酸迅速倒入盛有水的烧杯中,再把pH试纸放入其中测量 | |
| D. | 用干燥的pH试纸测定氢氧化钠稀溶液的pH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2ml反应后的混合溶液分别加入A、B两只试管 | (不用填) |
| 2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 有气泡冒出,品红溶液褪色 ,证明含有K2SO3 |
| 3 | 向B试管中,加入足量的足量的氯化钡溶液 溶液,再加入足量的稀盐酸; | 先有白色沉淀,后有气泡产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
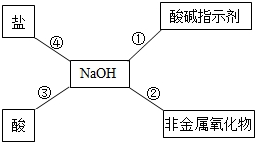 归纳总结是学习科学的重要方法之一,晓明同学用图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应).
归纳总结是学习科学的重要方法之一,晓明同学用图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com