
 (2013?嘉兴)如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.
(2013?嘉兴)如图是某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息,他带了一包食用纯碱到学校实验室.| 烧杯编号 | A | B | C | D |
| 水的质量/克 | 100 | 100 | 100 | 100 |
| 加入Na2CO3的质量/克 | 30 | 35 | 40 | 50 |
| 溶液的质量/克 | 130 | 135 | 140 | 140 |
| 106 |
| 5.4g×x |
| 44 |
| 2.2g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
 (2013?嘉兴)生活中有很多物品可以为科学实验所用,如图所示,玻璃瓶中都装满冷开水,并加入碳酸氢钠(一种CO2释放剂),将装置置于光照条件下,一段时间后,
(2013?嘉兴)生活中有很多物品可以为科学实验所用,如图所示,玻璃瓶中都装满冷开水,并加入碳酸氢钠(一种CO2释放剂),将装置置于光照条件下,一段时间后,查看答案和解析>>
科目:初中化学 来源: 题型:
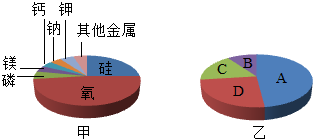 (2013?嘉兴)模型可以反映客观现象,简单明了地表示事物.
(2013?嘉兴)模型可以反映客观现象,简单明了地表示事物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com