
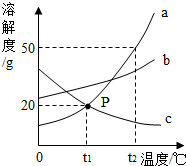
 请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:分析 溶解度曲线的交点表示该温度下,两种物质的溶解度相等;
饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶;
根据物质的溶解度曲线可以判断相关方面的问题.
解答 解:(1)P点的含义是:t1℃时,a和c的溶解度相等.
故填:t1℃时,a和c的溶解度相等.
(2)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,因为t1℃时b的溶解度大于a的溶解度,因此b的质量分数大于a的质量分数,因为a在t1℃时的溶解度大于c在t2℃时的溶解度,因此a的质量分数大于c的质量分数,溶液中溶质的质量分数由大到小的顺序是b>a>c.
故填:b>a>c.
(3)a的溶解度受温度变化影响较大,适合采取冷却热饱和溶液析出晶体.
故填:a.
(4)由溶解度曲线可知,a和b的溶解度随着温度的升高而增大,c的溶解度随着温度的升高而减小.
故填:a和b的溶解度随着温度的升高而增大.
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.


科目:初中化学 来源: 题型:选择题
| A. | CO2、SO2、H2O2三种物质中,都含有氧气 | |
| B. | Na、Na+具有相同的质子数,都属于同种元素 | |
| C. | NaOH、Ca(OH)2都是常见的碱,都可用于改良酸性土壤 | |
| D. | 不用任何试剂,都能用闻气味的方法检验某盐中是否含有NH4+ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 炭粉 | Cu粉 | 通入过量氧气,加热 |
| B | CO2气体 | CO | 通入过量氢氧化钠溶液 |
| C | NaCl | CaCO3 | 加入过量水溶解、过滤后取滤液,蒸发 |
| D | MgCl2溶液 | CuCl2 | 加入过量NaOH溶液,充分反应后过滤,得到滤液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 中和反应生成盐和水,生成盐和水的反应一定是中和反应 | |
| B. | 侯德榜制碱法,制出的火碱又叫烧碱 | |
| C. | 花香四溢,说明分子在不断地运动 | |
| D. | 铝比铁的抗锈蚀性能强,说明铝的金属活动性比铁弱 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 36% | B. | 40% | C. | 28.6% | D. | 26.5% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
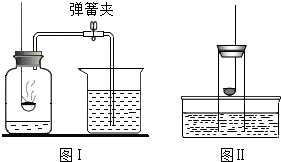 下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )| A. | 不能用木炭代替红磷 | |
| B. | 图II所示装置也可以测定空气中氧气含量 | |
| C. | 图I中进入集气瓶的水约占烧杯中水的五分之一 | |
| D. | 氮气不与红磷反应且难溶于水,是设计该实验的依据之一 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
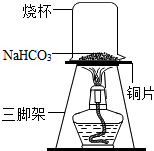 糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量氯化钙溶液,振荡,静置 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加酚酞溶液 | 溶液不变色 | 产物不含NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
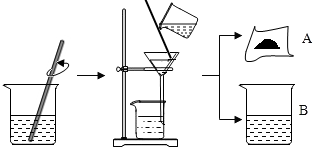
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜想正确 |
| 乙同学:取少量固体于试管中,加水溶解后过滤,向滤液中加入酚酞溶液 | 滤液变为红色 | 自己的猜想正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com