
| A. | 反应速率加快,得到氧气量增多 | B. | 反应速率加快,得到氧气量不变 | ||
| C. | 反应速率不变,得到氧气量不变 | D. | 反应速率不变,得到氧气量增多 |
科目:初中化学 来源: 题型:计算题
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 样品质量(g) | 1000 | 1000 | 1000 | 1000 |
| 氢氧化钠溶液质量(g) | 320 | 640 | 820 | 900 |
| 沉淀质量(g) | 23.2 | 46.4 | 58 | 58 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
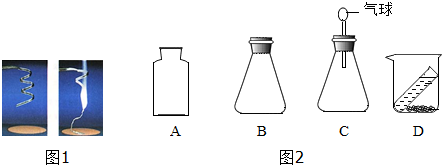
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水、氯化钠、铜都是由分子构成的 | |
| B. | 装空气的注射器容易被压缩是因为气体分子间间隔较大 | |
| C. | 离子是由原子得到或失去电子形成的 | |
| D. | 化学变化中分子可分,原子不可分 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
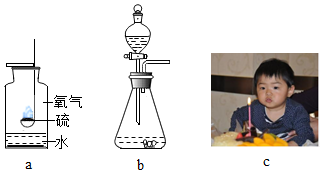
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
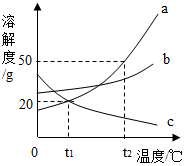 如图是三种固体物质的溶解度曲线,下列说法中正确的是( )
如图是三种固体物质的溶解度曲线,下列说法中正确的是( )| A. | a物质的饱和溶液变不饱和溶液,可以降低温度 | |
| B. | t2℃时,50g物质a与50g水充分混合后所得溶液的总质量为100g | |
| C. | t1℃时,a、c两物质溶液的溶质质量分数相等 | |
| D. | 分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为b>a>c |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验 | 主要操作步骤(如图1) | 主要实验现象 | 结论 |
| (1) | 在集气瓶中加入少量MnO2(黑色固体),在仪器a中加入新配制的“鱼浮灵”的饱和水溶液;打开仪器a的活塞,放出适量溶液后,在导管口放一根带火星的木条 | 有气泡逸出,能使带火星木条复燃 | “鱼浮灵”溶于水生成过氧化氢 |
| (2) | 关闭仪器a,在仪器b中加入稀盐酸,打开活塞,放出适量溶液后,在导管口放一燃着的木条 | 生成大量无色气泡,木条熄灭 | “鱼浮灵”溶于水生成碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com