
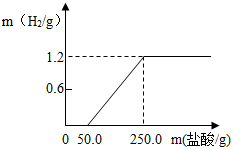
 某兴趣小组从废铝锅底部剪一块铝片,将它放入21.9%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应).请回答:
某兴趣小组从废铝锅底部剪一块铝片,将它放入21.9%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应).请回答:分析 (1)图象为产生氢气质量随所加盐酸质量变化情况.根据图象可知,放出氢气质量为1.2g;未被氧化的铝与盐酸发生置换反应,可以生成氯化铝和氢气;由反应放出氢气的质量,根据反应的化学方程式,计算与酸反应的铝片的质量;
(2)根据产生氢气的图象,当加入50.0g稀盐酸时开始与铝片发生反应,直到加入250.0g盐酸时恰好完全反应.由与氧化铝反应所消耗盐酸的质量,根据反应的化学方程式计算氧化铝的质量,由氧化铝中铝元素的质量分数求得被氧化的铝的质量,最后计算出被氧化的铝的质量占未氧化时铝片总质量的质量分数.
解答 解:(1)根据产生氢气的质量与消耗盐酸的质量图,可得生成氢气质量为1.2g;
设与200.0g盐酸反应的铝的质量为x
2Al+6HCl═2AlCl3+3H2↑
54 219
x 200.0g×21.9%
$\frac{54}{x}$=$\frac{219}{200.0g×21.9%}$
x=10.8g
(2)根据图象,与氧化铝反应的盐酸的质量为50.0g;设氧化铝的质量为y
Al2O3+6HCl═2AlCl3+3H2O
102 219
y 50.0g×21.9%
$\frac{102}{y}$=$\frac{219}{50.0g×21.9%}$
y=5.1g
被氧化的铝的质量=5.1g×$\frac{27×2}{27×2+16×3}$×100%=2.7g
被氧化的铝的质量占未氧化时铝片总质量的质量分数=$\frac{2.7g}{2.7g+10.8g}$×100%=20%
答:铝片中铝单质的质量为10.8g;
被氧化的铝的质量占未氧化时铝片总质量的质量分数为20%.
点评 解答此类问题的根本点在于对反应图象的曲线进行分析,曲线起点表示开始与铝发生反应放出氢气,曲线的折点表示此时恰好完全反应.


科目:初中化学 来源: 题型:选择题
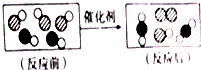
| A. | 分子在化学变化中可分 | |
| B. | 化学反应前后,原子种类不变 | |
| C. | 参加反应的两种分子的个数比为3:2 | |
| D. | 生成物中有单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ①⑤ | D. | ④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 序号 | 过氧化氢溶液 浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com