
分析 根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)反应前后的质量差即为生成氢气的质量,因此生成氢气的质量为:5.8g+60g-65.6g=0.2g,
答:生成了0.2g氢气.
(2)设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑,
56 2
x 0.2g
$\frac{56}{x}$=$\frac{2}{0.2g}$,
x=5.6g,
该生铁样品中铁的质量分数为:$\frac{5.6g}{5.8g}$×100%=96.6%,
答:该生铁样品中铁的质量分数为96.6%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


科目:初中化学 来源: 题型:选择题
| A. | 铝合金门窗变旧变暗后用砂纸或钢丝球打磨 | |
| B. | 铁桶中加入硫酸铜溶液 | |
| C. | 铝壶内的水垢用质量分数为18%的热盐酸长时间浸泡 | |
| D. | 校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 奥运会火炬采用中国传统祥云图案和纸卷轴为创意设计,其外壳由铝合金材料制成,使用的燃料是丙烷(C3 H8).1)铝的化学性质很活泼,与空气中的氧气反应,能在其表面生成一层致密的氧化铝(A1203)薄膜,因而铝又具有很好的抗腐蚀性能.
奥运会火炬采用中国传统祥云图案和纸卷轴为创意设计,其外壳由铝合金材料制成,使用的燃料是丙烷(C3 H8).1)铝的化学性质很活泼,与空气中的氧气反应,能在其表面生成一层致密的氧化铝(A1203)薄膜,因而铝又具有很好的抗腐蚀性能.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
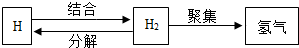
| A. | 原子可结合成分子 | |
| B. | 氢分子的形成过程可表示为: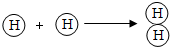 | |
| C. | 物质都是由分子构成 | |
| D. | 化学变化的实质是分子的分裂和原子的重新组合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com