某化学兴趣小组的同学提纯粗盐并用提纯得到的精盐配置一定溶质质量分数的溶液:
(1)称取5.0g粗盐进行提纯.粗盐除NaCl外,还含有泥沙、硫酸镁、氯化钙等杂质.将粗盐溶于水,然后通过如下操作即可得到较纯的氯化钠:a过滤;b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发.正确的操作顺序是 (填字母).操作中加入适量稀盐酸的目的是 .
(2)粗盐提纯正确的操作步骤是:溶解、过滤、 和计算产率;
(3)某同学所得精盐比其他同学明显要少,原因可能是 .
A.溶解时将5.0g粗盐一次全部倒入水中,立即过滤
B.蒸发时有一些液体、固体溅出
C.提纯后所得精盐尚未完全干燥
(4)利用提纯的精盐配制溶质质量分数为6%的NaCl溶液50g,正确的操作步骤是:计算、 、溶解、装瓶.
(5)NaCl溶解过程用到了玻璃棒,它的作用是 .
(6)配制50g溶质质量分数为6%的NaCl溶液,需NaCl g,水 mL.
(7)配制过程中除需要烧杯外,还需要的玻璃仪器有 .
【答案】分析:(1)泥沙为难溶的物质,应该用过滤的方法除去,而硫酸镁应该通过氢氧化钡来除去,除去氯化钙用碳酸钠,然后用稀盐酸来除去过量的碳酸钠,可以据此进行解答;
(2)根据粗盐的提纯方法进行解答;
(3)A、将粗盐倒入水中应该等氯化钠充分溶解后才能过滤;
B、液体或固体溅出会得到使得到的固体减少;
C、精盐没有完全干燥会导致精盐的质量偏大,可以据此进行解答;
(4)溶液的配制步骤为:计算、称量、溶解、装瓶,可以据此解答;
(5)玻璃棒在溶解的过程中起到了搅拌加速溶解的作用,可以据此解答;
(6)根据溶质的质量分数的计算公式进行解答;
(7)配制溶液时为了加速溶解通常用玻璃棒进行搅拌,可以据此解得该题.
解答:解:(1)硫酸根离子可以和钡离子结合形成硫酸钡沉淀,氢氧根离子可以和镁离子反应生成氢氧化镁沉淀,所以应该先加入过量的氢氧化钡溶液除去硫酸根离子和镁离子;钙离子可以和碳酸根离子结合形成碳酸钙沉淀,钡离子能够和碳酸根离子结合形成碳酸钡沉淀,所以接着应该加入过量的碳酸钠溶液来除去钙离子和过量的钡离子,然后通过过滤除去硫酸钡、氢氧化镁、碳酸钙和泥沙,此时滤液中含有的溶质为氯化钠和氢氧化钠和碳酸钠,而氢氧化钠和碳酸钠都能和稀盐酸反应,所以应该用稀盐酸来除去过量的碳酸钠和氢氧化钠,最后蒸发即得到较为纯净的氯化钠,所以正确的操作顺序为:bdace;
(2)粗盐提纯正确的操作步骤是:溶解、过滤、蒸发结晶和计算产率;
(3)A、将粗盐倒入水中应该等氯化钠充分溶解后才能过滤,故A正确;
B、液体或固体溅出会得到使得到的固体减少,故B正确;
C、精盐没有完全干燥会导致精盐的质量偏大,故C错误;
(4)溶液的配制步骤为:计算、称量、溶解、装瓶;
(5)玻璃棒在溶解的过程中起到了搅拌加速溶解的作用;
(6)根据溶质的质量分数的计算公式可以知道配制50g溶质质量分数为6%的NaCl溶液,需NaCl的质量为50g×6%=3g,水的质量为50g-3g=47g,水的密度为1
/mL所以需要水的体积为47mL;
(7)配制溶液时为了加速溶解通常用玻璃棒进行搅拌,用量筒来量取水,同时需要用到胶头滴管.
故答案为:(1)bdace;除掉过量的氢氧化钠和碳酸钠;
(2)蒸发结晶;
(3)AB;
(4)称量;
(5)搅拌,加速溶解;
(6)3;47;
(7)玻璃棒、量筒、胶头滴管.
点评:本题考查了粗盐提纯的相关知识,以及通过离子间的反应把杂质离子转化为沉淀和气体除去的方法,除杂时要注意加入试剂的量,且最后不能带入新的杂质.



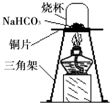 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.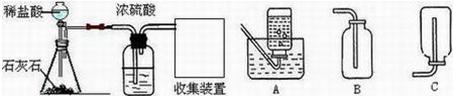
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.