
| A. | 不断搅拌 | B. | 降低温度 | C. | 蒸发溶剂 | D. | 升高温度 |
分析 根据不饱和溶液转变为饱和溶液的方法进行分析判断:增加溶质或蒸发溶剂,都可使不饱和溶液变成饱和溶液;对于溶解度随温度升高而增大的物质,降温可使不饱和溶液变成饱和溶液;对于溶解度随温度升高而减小的物质,升温可使不饱和溶液变成饱和溶液.
解答 解:A、不断搅拌,不能使不饱和溶液转化为饱和溶液,故选项方法一定不可行.
B、对于溶解随温度升高而增大的物质,降低温度,会使不饱和溶液变成饱和溶液;对于溶解度随温度降低而增大的物质,降低温度不饱和溶液仍不饱和;故选项方法不一定可行.
C、蒸发溶剂,能是某不饱和溶液转化为饱和溶液,故选项方法一定可行.
D、对于溶解随温度升高而增大的物质,升高温度会使不饱和溶液仍不饱和;对于溶解度随温度升高而减小的物质,升高温度可使不饱和溶液变成饱和溶液;故选项方法不一定可行.
故选:C.
点评 本题难度不大,掌握大多数物质不饱和溶液变成饱和溶液一般采取:增加溶质、蒸发溶剂、改变温度是正确解答本题的关键.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | 液体药品盛放在广口瓶中 | B. | 加热固体药品,试管口略向上倾斜 | ||
| C. | 有腐蚀性的药品放在纸上称量 | D. | 实验结束后,将废液倒入废液缸中 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
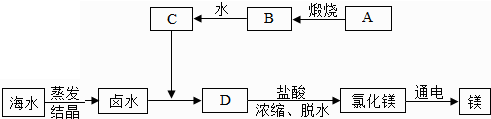
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
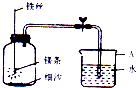 化学兴趣学习小组在做测定空气中氧气的含量的实验时,把红磷改为镁条.在空气中点 燃一段镁条后,迅速插入密闭的集气瓶中,镁条熄灭后,待冷却至室温后打开止水夹,发 现进入集气瓶中的水体相约占集气瓶体积的70%.兴趣小 组的同学对此现象进行了探宄.
化学兴趣学习小组在做测定空气中氧气的含量的实验时,把红磷改为镁条.在空气中点 燃一段镁条后,迅速插入密闭的集气瓶中,镁条熄灭后,待冷却至室温后打开止水夹,发 现进入集气瓶中的水体相约占集气瓶体积的70%.兴趣小 组的同学对此现象进行了探宄.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
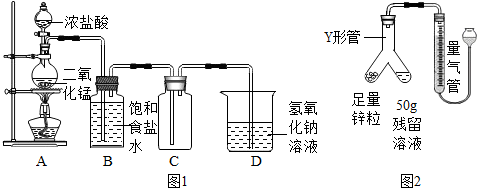
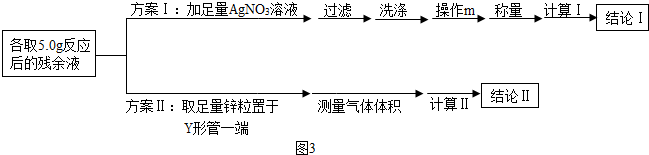
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com