
分析 铜锌合金中,只有锌和硫酸反应,所以根据质量守恒定律可知,引起质量减少的就是锌和硫酸反应生成的氢气,所以可知氢气的质量,进而根据化学方程式求算参加反应的锌的质量.然后计算合金中锌的质量分数.
解答 解:由于铜和锌,只有锌能够和硫酸反应,所以加入足量硫酸时,剩余固体为铜.而锌和硫酸反应生成硫酸锌和氢气,所以导致试管内总质量减少是因为氢气跑掉,也就是根据质量守恒定律可知,生成的氢气的质量为0.2g.
设生成0.2g氢气需要的锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{2}$=$\frac{x}{0.2g}$
x=6.5g
则样品中锌的质量分数为$\frac{6.5g}{10g}$×100%=65%
故答案为:(1)铜或者Cu(2)氢气或H2;(3)65%
点评 铜锌中只有锌能够和酸反应,所以剩余固体为铜.引起质量变化是因为过程生成了气体.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | X | Y | Z | W |
| 反应前的质量/g | 10 | m | 8 | 7 |
| 反应后的质量/g | 2 | 3 | 30 | 25 |
| A. | 若W为水,则X为氧气,Y一定是氢气 | B. | m的数值为32 | ||
| C. | 该反应不可能为氧化反应 | D. | 参加反应的X与Y的质量比为1:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 试管外壁必须保持干燥 | |
| B. | 给物质加热,应该用酒精灯的外焰 | |
| C. | 手拿试管给试管里的固体加热 | |
| D. | 先给试管中的固体预热,再集中加热 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
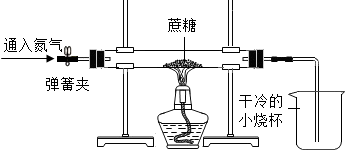
| 实验过程 | 实验现象 |
| 先在烧杯中加入加入澄清石灰水, 后通入氧气,点燃酒精灯. | ①硬质玻璃管中的黑色固体剧烈燃烧,发成白光; ②石灰水变浑浊. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com