
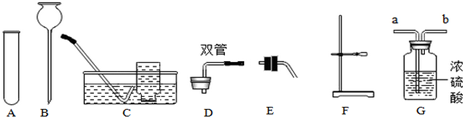
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;
利用排水法收集气体时,刚出现气泡不能立即收集,因为这时排出的气体主要是空气;
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,洗气装置中导管要长进短出.
解答 解:(1)上图中仪器A的名称是试管,常用作反应容器;
(2)若用氯酸钾制取氧气,还需要酒精灯加热,氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,该反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
若选用C装置收集氧气,开始收集的适宜时刻是气泡均匀、连续冒出时,因为开始出来的气体中含有试管内的空气;
(3)若用大理石和盐酸制取二氧化碳,除选用A、B外,还需选用上图中的带导管的双孔橡皮塞D和铁架台F组装成发生装置;
要收集干燥的该气体,应将装置与G中的a端相连接,让气体与浓硫酸充分接触;
故答案为:(1)试管;
(2)酒精灯;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)DF;a.
点评 明确实验室制取气体的反应原理、装置选取、常用仪器、洗气装置中导管长进短出即可顺利解答.


科目:初中化学 来源: 题型:选择题

| A. | 低的蜡烛先灭,因为二氧化碳的密度比空气的密度大 | |
| B. | 高的蜡烛先灭,气体受热膨胀,二氧化碳会上升,聚在玻璃杯的上方 | |
| C. | 该实验说明人从着火的房间逃离时,必须呈站立姿势跑出 | |
| D. | 两只蜡烛同时熄灭,因为玻璃杯中充满了二氧化碳气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
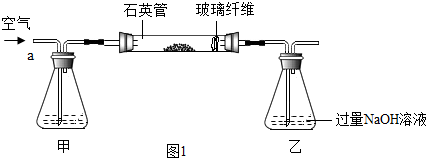
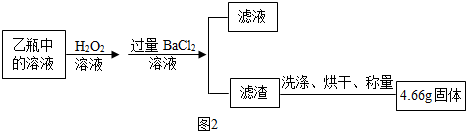
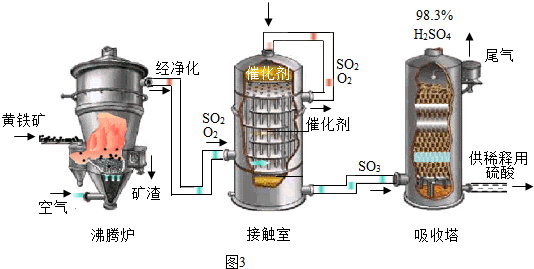
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
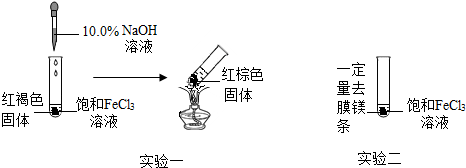
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
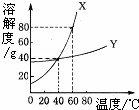 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若56 g CO参加反应,则消耗O2的质量一定是32 g | |
| B. | 若16 g O2参加反应,则生成CO2的质量一定是44 g | |
| C. | 若10 g CO2生成,则消耗CO和O2的质量总和一定是10 g | |
| D. | 若5 g CO与2 g O2混合点燃,则生成CO2的质量一定是7 g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com