
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:初中化学 来源: 题型:选择题
| A. | 电解水时在正极产生氧气 | B. | 实验证明水是由氢气和氧气组成的 | ||
| C. | 水中氢、氧元素的质量比为2:1 | D. | 水分子是由氢分子和氧原子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食盐水除去暖水瓶中的水垢 | |
| B. | 发现有人煤气中毒时立即将其移至通风处 | |
| C. | 热的纯碱溶液洗涤餐具上的油污 | |
| D. | 车船表面喷涂油漆以防生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 现有A、B、C、D、E、F、G七种物质,C和F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:
现有A、B、C、D、E、F、G七种物质,C和F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 给定氧气的质量 | 1.5g | 16g | 20g |
| 生成二氧化硫质量 | 3.0g | 32g | 32g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 为了测定空气中氧气的含量,小华设计了如下方案:选用实际溶剂为40ml的直玻璃管作反应容器,将过量的白磷放入试管,用橡皮塞紧直玻璃管,通过导管与实际容积为60mL的且润滑性很好的针筒注射器组成如图所示的实验装置.假设此装置能按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
为了测定空气中氧气的含量,小华设计了如下方案:选用实际溶剂为40ml的直玻璃管作反应容器,将过量的白磷放入试管,用橡皮塞紧直玻璃管,通过导管与实际容积为60mL的且润滑性很好的针筒注射器组成如图所示的实验装置.假设此装置能按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
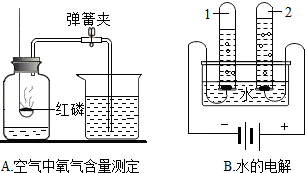 氧气和水是我们身边重要的物质.A、B都是研究物质组成和性质的实验.
氧气和水是我们身边重要的物质.A、B都是研究物质组成和性质的实验.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
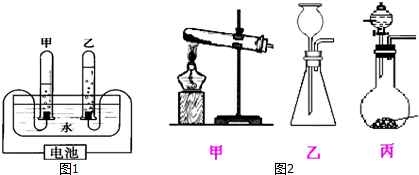
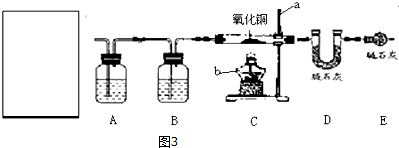
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com