
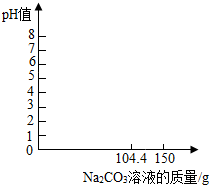
 ij��ȤС����Ҫ����100g��������Ϊ9.8%��ϡ���ᣬ���賣���¸�ϡ�����PHֵΪ0����װ��100g��ϡ������ձ��м���104.4gNa2CO3��Һ��ǡ����ȫ��Ӧ����Һ�����ԣ�
ij��ȤС����Ҫ����100g��������Ϊ9.8%��ϡ���ᣬ���賣���¸�ϡ�����PHֵΪ0����װ��100g��ϡ������ձ��м���104.4gNa2CO3��Һ��ǡ����ȫ��Ӧ����Һ�����ԣ����� ��1����������Ļ�ѧʽ��H2SO4��������Է���������
��2����������Ļ�ѧʽ��H2SO4�������������ԭ�ӡ���ԭ�ӵ�ԭ�Ӹ����ȣ�
��3������������������ԭ���������㣻
��4������ϡ���������ʵ�����������ɵ������Ƶ�������������̼���������ٸ����������������ļ��㹫ʽ���������Һ����������������
��� �⣺��1�����ᣨH2SO4������Է�������Ϊ��1��2+32+16��4=98��
��2�����ᣨH2SO4������ԭ�ӡ���ԭ�ӵ�ԭ�Ӹ�����Ϊ��4��2=2��1
��3������������������ԭ����֪��ʵ����ֻ��98%��Ũ���ᣬ�ܶ�Ϊ1.84g/cm3����Ҫ��ȡ�������v��
100g��9.8%=v��1.84g/cm3��98% ��ã�v=5.4mL
ֻҪ����104.4��ʱPH=7��������̼����PH��7���������ϼ��ɣ�
��4������104.4��̼����Һ��ȫ��Ӧ����Һ�����ԣ�������Һ����������Һ���跴Ӧ����Na2SO4����Ϊx����Ӧ����CO2����Ϊy��
Na2CO3+H2SO4�TNa2SO4+H2O+CO2����
98 142 44
100g��9.8% x y
$\frac{98}{100g��9.8%}$=$\frac{142}{x}$=$\frac{44}{y}$
������Һ��������������Ϊ��$\frac{14.2g}{100g+104.4g-4.4g}$��100%=7.1%����
�ʴ�Ϊ����1��98��
��2��2��1��
��3��5.4��
��4��������Һ����������Ϊ7.1%��
���� ������Ҫ����ѧ�����ü��跨�ͻ�ѧ����ʽ���м�����ƶϵ�����������ʱҪע��淶�Ժ�ȷ�ԣ�


 С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
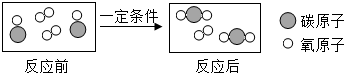
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ��ˮ ������̼ | B�� | ���� ú | ||
| C�� | �����������ˮ ��Ƭ | D�� | ��ˮ����� Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 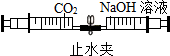 CO2�����ռ���Һ��Ӧ | B�� | 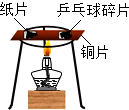 ��ͬ���ʵ��Ż�㲻ͬ | ||
| C�� | 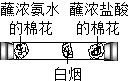 �����ڲ����˶� | D�� |  �����غ㶨�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KCl | B�� | NH4Cl | C�� | Na2SO4 | D�� | Ca��H2PO4��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ֻ�ȴ���ˮ | B�� | �����ʱҪ����Ͳ��Ҫ���� | ||
| C�� | ���������ƴ���ʳ������ζƷ | D�� | ��Ũ���ᵹ��ʢ��ˮ����Ͳ��ϡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ijУ����С��̽������ͭ��ϡ���ᣨHNO3����Ӧ��������һ��������NO�����壬�����ͼ��ʾʵ��װ�ã�����װ�ú̶�װ�þ�����ȥ������ʾ��ͼ��K1��K2Ϊֹˮ�У����ڹر�״̬����B�е�ע�����к���һ����������
ijУ����С��̽������ͭ��ϡ���ᣨHNO3����Ӧ��������һ��������NO�����壬�����ͼ��ʾʵ��װ�ã�����װ�ú̶�װ�þ�����ȥ������ʾ��ͼ��K1��K2Ϊֹˮ�У����ڹر�״̬����B�е�ע�����к���һ�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com