
| 温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 温度(℃) | 0 | 10 | 20 | 30 | … | 90 | |
| 纯碱(克) | 7.1 | 12.5 | 21.5 | 38.8 | … | 43.9 | |
分析 “冬天捞碱,夏天晒盐”依据的是氯化钠与碳酸钠的溶解受温度影响不同的原理进行的,通过题目中的信息,分析两种物质的溶解度变化特点,进行分解答.
解答 解:由Na2CO3的部分温度下的溶解度表可知,碳酸钠的溶解度受温度影响变化较大,溶解度受温度影响变化比较大的固体物质一般用降温结晶的方法获得晶体;冬天气温低,碳酸钠的溶解度减小,碳酸钠易结晶析出.
由NaCl的部分温度下的溶解度表可知,氯化钠的溶解度受温度影响变化不大,溶解度受温度影响变化比较小的固体物质一般用蒸发结晶的方法获得晶体;夏天温度高,水分蒸发快,氯化钠乙结晶析出.
故答案为:冬天捞碱:碳酸钠的溶解度受温度影响变化较大,冬天气温低,碳酸钠的溶解度减小,碳酸钠易结晶析出;
夏天晒盐:氯化钠的溶解度受温度影响变化不大,夏天温度高,水分蒸发快,氯化钠乙结晶析出.
点评 本题难度不大,掌握降温结晶和蒸发结晶的原理并能灵活运用是正确解答本题的关键.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源:江苏省无锡市长泾片2017届九年级下学期第二次模拟考试化学试卷 题型:简答题
氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来制取氧化锌,其流程如下图所示:
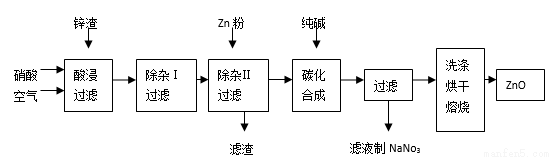
信息:1、3FeO+10HNO3==3Fe(NO3)3+NO+5H2O,NO有毒,能与氧气和水反应生成硝酸。 2、在“除杂Ⅰ”步骤中,只有铁离子能形成氢氧化铁沉淀。
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,理由是________;通入空气的目的是:①起搅拌作用,使反应充分,②___________。通入空气反应的化学方程式为________________________________。
(2)在“除杂Ⅰ”步骤中,加入一种金属氧化物与过量的硝酸反应,使溶液pH升高为4左右,请结合本厂实际,可加入的物质是(______)
A、 ZnO B、 FeO C、Fe2O3 D、CuO
(3)为了使产品更加纯净,在“除杂Ⅱ”步骤中,滤渣的成分是_____________________。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],还生成一种能使澄清石灰水变浑浊的气体氧化物。请写出碳化合成步骤的化学方程式__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | M | N | Q | P |
| 反应前质量(g) | 18 | 1 | 2 | 32 |
| 反应后质量(g) | X | 26 | 2 | 12 |
| A. | 该变化的基本反应类型是分解反应 | B. | 反应后物质X的值为l3 | ||
| C. | 反应中N、P的质量比为5:4 | D. | 物质Q可能是该反应的催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
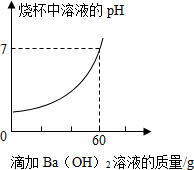 某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:
某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:| 滴加氢氧化钡溶液的质量/克 | 5 | 10 | 25 |
| 烧杯中产生沉淀的质量/克 | 1.165 | m | 4.66 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 浓度限值(mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 电池在现代生活中用途越来越广泛,小明想了解电池的工作原理,在网上找到如图,箭头表示电流的方向,请帮小明判断该电池的正极是铜片(填“铜片”或“锌片”),它的能量转化是化学能转化为电能.
电池在现代生活中用途越来越广泛,小明想了解电池的工作原理,在网上找到如图,箭头表示电流的方向,请帮小明判断该电池的正极是铜片(填“铜片”或“锌片”),它的能量转化是化学能转化为电能.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 气体 性质 | H2 | CO2 | O2 | N2 | Cl2 |
| 气体的沸点/℃ | -252 | -78 | -183 | -196 | -34 |
| 被吸附体积/mL | 4.5 | 97 | 35 | 11 | 494 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com