
分析 (1)根据煤的质量及其硫的质量分数可以计算一定量的煤中含有二氧化硫的质量;硫燃烧生成二氧化硫,根据硫的质量可以计算二氧化硫的质量;
(2)通过计算排放的废气中二氧化硫的含量,可以判断排放的废气是否符合国家规定的工业废气排放标准;
(3)根据氢氧化镁的质量求出二氧化硫的质量即可.
解答 解:(1)设每天该厂排放到空气中的二氧化硫的质量为x,
4800kg煤中硫的质量为:4800kg×2%=96kg,
S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2
32 64
96kg x
$\frac{32}{96kg}=\frac{64}{x}$
x=192kg
答:每天该厂排放到空气中的二氧化硫质量为192kg.
(2)解:设500mL废气样品中二氧化硫的质量为y,
SO2+2H2O+I2═H2SO4+2HI,
64 254
y 4×10-4mg
$\frac{64}{y}=\frac{254}{4×1{0}^{-4}mg}$
x=1.0×10-4mg,
该厂排放的废气中,二氧化硫的浓度为:1.0×10-4mg÷500mL=0.20mg/m3,
因为0.20mg/m3>0.15mg/m3,所以该厂排放的废气不符合国家规定的工业废气排放标准;
(3)设理论上可吸收SO2的质量为z.
Mg(OH)2+SO2=MgSO3+H2O
58 64
100kg×5.8% z
$\frac{58}{100kg×5.8%}=\frac{64}{z}$
z=6.4kg
答:理论上可吸收SO2的质量为6.4kg.
点评 本题比较简单,主要考查学生运用假设法和化学方程式进行计算和推断的能力,由于数据比较复杂,要注意计算的准确性.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
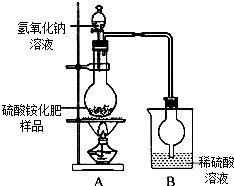 硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)
硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 下表列出了硝酸钾在不同温度下的溶解度.
下表列出了硝酸钾在不同温度下的溶解度. | 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 事 实 | 解 释 |
| ① | 5毫升水和5毫升酒精混合后体积小于10毫升 | 分子的体积很小 |
| ② | NaOH溶液、Ca(OH)2溶液均显碱性 | 溶液 中都含有氢氧根离子 |
| ③ | O2和O3的化学性质不同 | 物质组成元素不同 |
| ④ | 浓硫酸能干燥气体 | 浓硫酸具有吸水性 |
| A. | ①②③ | B. | ②③④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | CO2+H2O═H2CO3 | ||
| C. | 2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O | D. | Ca(HCO3)2═CaCO3↓+CO2↑+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化铁、FeCl2、盐 | B. | 干冰、CO2、氧化物 | C. | 生石灰、CaCO3、盐 | D. | 纯碱、NaOH、碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 自制泡菜,卫生有保障,原料配比随意.但也有不尽人意之处,即保存时间稍长,味道变酸,剌激肠胃.
自制泡菜,卫生有保障,原料配比随意.但也有不尽人意之处,即保存时间稍长,味道变酸,剌激肠胃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com