

·ÖĪö £Ø1£©¶žŃõ»ÆĮņÄÜŗĶĖ®·“Ӧɜ³ÉŃĒĮņĖį£¬ÄÜŗĶ¼īČÜŅŗ·“Ӧɜ³ÉŃĪŗĶĖ®£»
£Ø2£©·“Ó¦Īļ½Ó“„Ō½³ä·Ö£¬·“Ó¦ĖŁĀŹŌ½æģ£¬·“Ó¦Ņ²Ō½³¹µ×£»
£Ø3£©øł¾ŻĶ¼ÖŠµÄ¹¤ŅÕĮ÷³ĢæÉŅŌÅŠ¶ĻæÉŃ»·Ź¹ÓƵÄĪļÖŹ£»
£Ø4£©ĮņĖį¼ŲŅ×ČÜÓŚĖ®£¬²»ČÜÓŚ±„ŗĶĮņĖį¼ŲČÜŅŗ£®
½ā“š ½ā£ŗ£Ø1£©¶žŃõ»ÆĮņÄÜŗĶĖ®·“Ӧɜ³ÉŃĒĮņĖį£¬ÄÜŗĶ¼īČÜŅŗ·“Ӧɜ³ÉŃĪŗĶĖ®£¬Ņņ“ĖĶŃĮņ¹ż³ĢÖŠæÉÓĆĖ®»ņ¼īČÜŅŗÅēĮÜŃĢĘųĄ“ĪüŹÕSO2£®
¹ŹĢī£ŗĖ®»ņ¼īČÜŅŗ£®
£Ø2£©ŹÆøąÓė±„ŗĶ£ØNH4£©2CO3ČÜŅŗĻą»ģŗĻ£¬·¢Éś·“Ó¦¢ńŹ±²»¶Ļ½Į°č£¬ĘäÄæµÄŹĒŹ¹·“Ó¦Īļ³ä·Ö½Ó“„£¬ĢįøßŌĮĻĄūÓĆĀŹ£®
¹ŹĢī£ŗŹ¹·“Ó¦Īļ³ä·Ö½Ó“„£¬ĢįøßŌĮĻĄūÓĆĀŹ£®
£Ø3£©ĮņĖįøĘŗĶĢ¼Ėįļ§·“Ӧɜ³ÉĮņĖįļ§ŗĶĢ¼ĖįøĘ£¬¹żĀĖŗóĢ¼Ėįøʱ»ÖŲŠĀ¼ÓČėµ½ĶŃĮņÖŠČ„£¬·“Ó¦ÓÖÉś³ÉĮņĖįøĘ£¬Ņņ“ĖÉĻŹöĮ÷³ĢÖŠæÉŃ»·Ź¹ÓƵÄĪļÖŹŹĒCaCO3£®
¹ŹĢī£ŗCaCO3£®
£Ø4£©ÓƱ„ŗĶK2SO4ČÜŅŗĻ“µÓ·“Ó¦¢ņĖłµĆ¾§Ģ壬²»ÓĆĖ®Ļ“µÓµÄŌŅņŹĒ·ĄÖ¹ĮņĖį¼ŲČÜÓŚĖ®£®
¹ŹĢī£ŗ·ĄÖ¹ĮņĖį¼ŲČÜÓŚĖ®£®
µćĘĄ ŗĻĄķÉč¼ĘŹµŃ飬æĘѧµŲ½ųŠŠŹµŃ锢·ÖĪöŹµŃ飬ŹĒµĆ³öÕżČ·ŹµŃé½įĀŪµÄĒ°Ģį£¬Ņņ“ĖŅŖѧ»įÉč¼ĘŹµŃ锢½ųŠŠŹµŃ锢·ÖĪöŹµŃ飬ĪŖѧŗĆ»ÆѧÖŖŹ¶µģ¶Ø»ł“”£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
| ³É·Ö | ŹŅÄŚæÕĘų | Õż³£ŗō³öµÄĘųĢå | ±ä»ÆÖµ |
| ŃõĘų | 20.77% | 17.17% | 3.60% |
| ¶žŃõ»ÆĢ¼ | 0.056% | 3.67% | 3.614% |
| Ė®ÕōĘų | 1.98% | 2.50% | 0.52% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
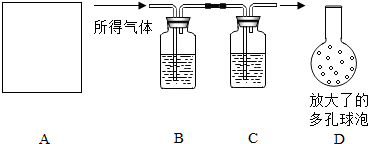 ĪŖĮĖ²ā¶ØijŹÆ»ŅŹÆæóŃłµÄ“æ¶Č£ØĘäÖŠĖłŗ¬ŌÓÖŹ²»ÓėĖį·“Ó¦£©£¬Ä³Ķ¬Ń§°“ČēĻĀĮ÷³Ģ½ųŠŠŹµŃé£ŗÓĆŃĪĖįČܽāæóŃł”śøÉŌļĖłµĆĘųĢå”śÓĆNaOHČÜŅŗĪüŹÕĘųĢå”śøł¾ŻNaOHČÜŅŗµÄŌöÖŲĮæ¼ĘĖćæóŃłµÄ“æ¶Č£®ŹµŃé¹ż³ĢÖŠĖłČ”æóŃłµÄÖŹĮæĪŖ10g£®ŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£ŗ
ĪŖĮĖ²ā¶ØijŹÆ»ŅŹÆæóŃłµÄ“æ¶Č£ØĘäÖŠĖłŗ¬ŌÓÖŹ²»ÓėĖį·“Ó¦£©£¬Ä³Ķ¬Ń§°“ČēĻĀĮ÷³Ģ½ųŠŠŹµŃé£ŗÓĆŃĪĖįČܽāæóŃł”śøÉŌļĖłµĆĘųĢå”śÓĆNaOHČÜŅŗĪüŹÕĘųĢå”śøł¾ŻNaOHČÜŅŗµÄŌöÖŲĮæ¼ĘĖćæóŃłµÄ“æ¶Č£®ŹµŃé¹ż³ĢÖŠĖłČ”æóŃłµÄÖŹĮæĪŖ10g£®ŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® |  | B£® |  | ||
| C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
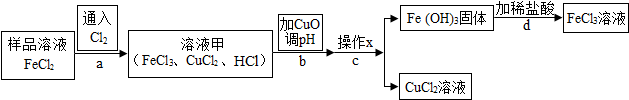
| Fe£ØOH£©3 | Cu£ØOH£©2 | |
| æŖŹ¼³ĮµķµÄpH | 1.9 | 4.7 |
| ³ĮµķĶźČ«µÄpH | 3.2 | 6.7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
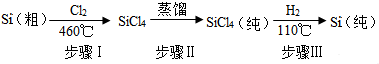
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
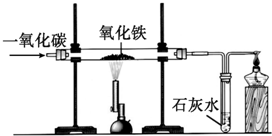
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķā³öŹ±Åå“÷·“Īķö²æŚÕÖ | B£® | Ģį³«ĀĢÉ«³öŠŠ£¬·¢Õ¹¹«¹²½»ĶØ | ||
| C£® | Ö²Ź÷ĀĢ»Æ£¬ĆĄ»Æ»·¾³ | D£® | ¼õÉŁĆŗĢæ·¢µē£¬Ōö¼ÓĢ«ŃōÄÜ·¢µē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ōĒ»łĮ×»ŅŹÆŹĒĪŽ»śĪļ | |
| B£® | ÕāÖÖÄĶ»šµÖæÉ×÷ĪŖ×čČ¼²ÄĮĻŗĶÄĶøßĪĀ²ÄĮĻµČ | |
| C£® | ōĒ»łĮ×»ŅŹÆÖŠĒā”¢ŃõŌŖĖŲÖŹĮæ±ČĪŖ1£ŗ208 | |
| D£® | ōĒ»łĮ×»ŅŹÆÖŠŗ¬ÓŠ10ÄźøĘŌ×Ó£¬2øöĒāŌ×Ó£¬26øöŃõŌ×Ó£¬6øöĮ×Ō×Ó£® |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com