
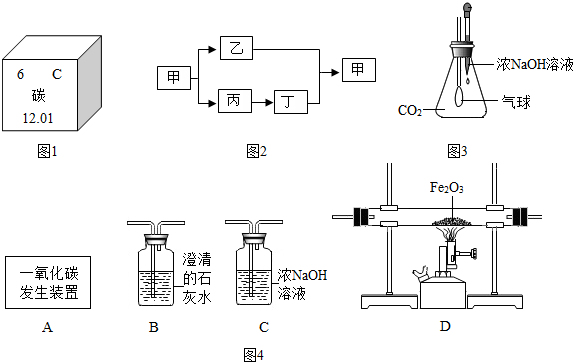
���� ��1������̼������Ǽ��ٶ�����̼���ŷ�����
��2������Ԫ�����ڱ��е�һ��С���е���Ϣ��֪Ԫ�ص����ơ�Ԫ�ط��š������������ԭ������������ɣ�
��3������Ŀ��Ϣ��֪�������к���̼Ԫ�أ����������������˱�����ʯ�ң�����̼��ƣ����Ƕ�����̼��������ʯ�ң�
��4������CO2��ŨNaOH��Һ���գ���ƿ�ڵ���ѹ��С��������ѹ������ƿ�ڵ���ѹ��ʹ�����ʹ���
��5������CO��Fe2O3��Ӧ�������Ͷ�����̼���
��6����Ӧǰ���ձ��������ļ�������Ϊ���ɵĶ�����̼�����������ݻ�ѧ����ʽ�ж�����̼�����������̼��Ƶ�����������������ʵ�����������
��� �⣺��1������̼������Ǽ��ٶ�����̼���ŷ�����
�ʴ�Ϊ��CO2��
��2��A����̼��ƫ��Ϊ��ʯ������̼Ԫ��Ϊ�ǽ���Ԫ�أ���A˵����ȷ��
B������Ϣ��֪��̼ԭ�ӵ�������Ϊ6����B˵����ȷ��
C��̼ԭ�ӵ�������Ϊ6����ԭ�ӽṹ������������ӦΪ4����C����
D������Ϣ��֪��̼ԭ�ӵ����ԭ������Ϊ12.01����D˵����ȷ��
��ѡC��
��3�������к���̼Ԫ�أ�����������������Կ���������ʯ�ң�����̼��ƣ����Ƕ�����̼����˼Ļ�ѧʽΪCaCO3����ת��Ϊ���Ļ�ѧ����ʽΪCaO+H2O=Ca��OH��2��
�ʴ�Ϊ��CaCO3��CaO+H2O=Ca��OH��2��
��4��CO2��ŨNaOH��Һ���գ���ƿ�ڵ���ѹ��С��������ѹ������ƿ�ڵ���ѹ��ʹ�����ʹ� ��ѧ����ʽΪ 2NaOH+CO2=Na2CO3+H2O
��5��CO��Fe2O3��Ӧ�������Ͷ�����̼����ѧ����ʽΪ Fe2O3+3C0$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2 ���������̼Ӧ�ó���ʯ��ˮ����˳��ΪC��D��B һ����̼�ж����ŷŵ������л���Ⱦ��������Ӧ��β����ȼ������ռ�������
��6����Ӧǰ���ձ��������ļ�������Ϊ���ɵĶ�����̼�����������ݻ�ѧ����ʽ�ж�����̼�����������̼��Ƶ�����������������ʵ�����������
����CO2��������12.5 g+50 g-58.1g=4.4g
��ʯ��ʯ��CaCO3������Ϊx��
CaCO3+2HCl=CaCl2+CO2��+H2O
100 44
x 4.4g
$\frac{100}{x}=\frac{44}{4.4g}$
x=10g
ʯ��ʯ�����ʵ���������Ϊ��$\frac{12.5g-10g}{12.5g}$��100%=20%
�ʴ�Ϊ����1��CO2��
��2��C��
��3��CaCO3�� CaO+H2O=Ca��OH��2��
��4��CO2��ŨNaOH��Һ���գ���ƿ�ڵ���ѹ��С��������ѹ������ƿ�ڵ���ѹ��ʹ�����ʹ� 2NaOH+CO2=Na2CO3+H2O
��5����Fe2O3+3C0$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2�� ��C��D��B���۽�β����ȼ������ռ��ȣ�
��6��ʯ��ʯ�����ʵ���������Ϊ20%��
���� ���⿼��ѧ������Ԫ�����ڱ��е�һ��С��������ȡ��Ϣ���ϰ�⣬����ѧ��������Ϣ������Ϣ������������ȷ��ͬλ�õ����ֵ����������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
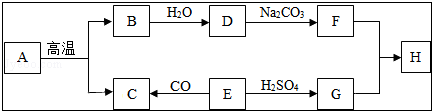
| X | Y | Z | Q | |
| ��Ӧǰ������/g | 8 | 10 | 1 | 21 |
| ��Ӧ�������/g | 0 | 21 | ���� | 9 |
| A�� | ��Ӧ������Z������Ϊ9g | |
| B�� | ��Ӧ����Y������Ϊ11g | |
| C�� | ��Ӧ������Y��Q�����ı������֮��Ϊ1��1 | |
| D�� | �÷�Ӧ�Ļ�ѧ����ʽ�У�����X��Q�Ļ�ѧ������֮��Ϊ2��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������У����ü��ȸ�����صķ����Ƶô��������� | |
| B�� | ��������ˮ�����棬֤��������������ˮ | |
| C�� | ľ̿�ڿ��������պ��ȣ���������ȼ�ղ������⣬����ͬ��������Ũ���й� | |
| D�� | ��������������������ԼΪ21% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������̼ͨ����ɫʯ����Һ�У���Һ����ɫ��Ϊ��ɫ | |
| B�� | Fe��OH��3�м�����ɫ��̪��Һ����̪��Һ����ɫ | |
| C�� | �����ڿ�����ȼ�ղ����������� | |
| D�� | ���ں���ë��ȼʱ�����ŵ��ս���ë����ζ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ɽ���� | B�� |  ������ | C�� |  ����ľ�� | D�� |  ���ײ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com