
【题目】元素周期表是学习和研究化学的重要工具,试根据图示回答相应问题。
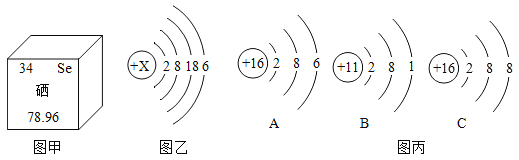
(1)图甲是硒元素在元素周期表中的信息,则硒元素属于_______元素(填“金属”或“非金属”)。硒元素的相对原子质量是_________。
(2)图乙是某原子结构示意图,其中X的值是______,该元素的化学性质与图丙______(填序号)微粒的化学性质相似。
(3)氢氧化钙俗称熟石灰,在生产和生活中有广泛的用途.用熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合可制得高效环保农药“黑白粉”.使用时,选择在有露水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体.“黑白粉”还可提供植物必需的营养素是_____(填元素符号).
(4)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是________________.
【答案】非金属 78.96 34 A K Cu(或铜)
【解析】
(1)由元素汉字名称的偏旁“石”字可知,该元素属于非金属元素;由元素周期表的信息可知,硒元素的相对原子质量是78.96;故填:非金属;78.96;
(2)原子中,质子数=核外电子数,所以X=2+8+18+6=34;其原子的最外层有6个电子,A粒子的最外层也是6个电子,所以二者化学性质相似;故填:34;A;
(3)“黑白粉”中含有植物生长必须的营养元素钾元素,则“黑白粉”还可提供植物必需的营养素是K.故填:K;
(4)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,说明混入的杂质中有一种比锌生成的氢气少的金属或不产生氢气的金属,有一种或几种比锌产生多的金属,而不产生氢气的金属只有铜;故答案为:Cu(或铜).


科目:初中化学 来源: 题型:
【题目】硼(B)及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和难溶性SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

已知:①Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3②CaSO4微溶于水
2MgSO4+2H3BO3②CaSO4微溶于水
③H2O2溶液可将Fe2+氧化为Fe3+④Fe3+、Fe2+、Al3+以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.14 | 3.0 |
Fe2+ | 5.85 | 8.35 |
Al3+ | 3.0 | 4.7 |
请回答下列问题:
(1)利用______(填物质名称)的磁性,可将该物质直接从“铁硼矿粉”中分离。
(2)酸浸时,矿粉中的金属氧化物会和酸反应,试写出Fe2O3酸浸时的化学反应方程式__________。
(3)为了提高浸出速率(即加快反应速率),除适当增加硫酸浓度外,还可采取的措施有______(写出一条)。
(4)操作a为______,“浸渣”中含有CaSO4和______(填物质化学式)。
(5)“净化除杂”需先加H2O2溶液,然后再调节溶液的pH约为5,目的是_____。
(6)制得的粗硼酸中的主要杂质为________________(填物质化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。
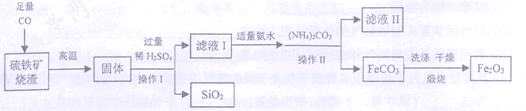
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、 等。
(2)滤液Ⅰ中主要的阳离子是 等。
(3)加适量氨水的目的是 。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是 。
(5)滤液Ⅱ中可回收的产品是 (写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:
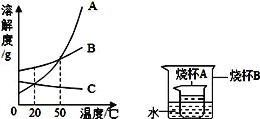
【题目】如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于p点.据图回答:

(1)t2℃时30ga物质加入到50g水中不断搅拌,能形成________g溶液.
(2)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是________(填写物质序号).
(3)将t1℃时 a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是________(填写选项序号).
A c>a=b B a=b>c C a>b>c D b>a>c
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A是红棕色粉末,B是白色沉淀,D为红褐色沉淀,Y的溶液显蓝色,X和G都是黑色固体,结合图中信息,回答有关问题
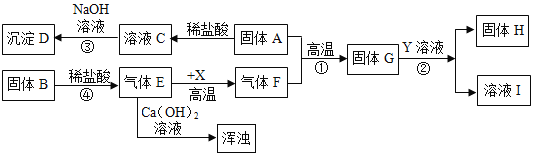
(1)沉淀D的化学式是:__________,固体H的化学式:________
(2)写出反应②的化学方程式:_________,写出反应③的化学方程式:___________,该反应属于_________反应(填基本反应类型)
(3)溶液C的颜色是:_________
(4)Y溶液在农业上的应用:_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据溶解度受温度影响的信息和溶解度曲线回答下列问题:
已知硝酸钾的溶解度受温度影响比较大,食盐的溶解度受温度影响较小,熟石灰的溶解度随温度升高而减少.
(1)A是__的溶解度曲线.
(2)50℃时,硝酸钾的溶解度______(大于、小于或等于)氯化钠的溶解度.
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是__.
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是__.
(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是__(填序号).
A.反应放热,温度升高,氢氧化钙溶解度降低
B.反应消耗水,氢氧化钙析出
C.生石灰与水反应生成的氢氧化钙不再溶解.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高锰酸钾在生产、生活中有广泛应用。实验小组的同学对高锰酸钾的某些性质和用途进行探究。
实验一、高锰酸钾制取氧气:如图,用下列给定的药品、用品:高锰酸钾、棉花、火柴及下列仪器,制取氧气.
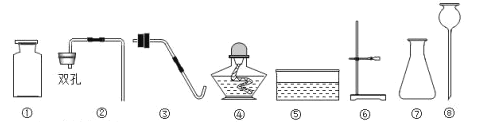
(1)仪器⑤的名称是_______________;
(2)制取并收集氧气时,应选用图中的仪器有_________。(填序号);利用此原理还需要补充的一种仪器是_________,在此实验中该仪器的用途是___________,该反应的方程式为:________________,根据所给仪器收集该气体应采用的收集方法是____。
(3)实验时需要使用酒精灯,下列使用酒精灯的操作正确的是__________(从图中选出正确的操作编号).

(4)小明用高锰酸钾制备氧气实验结束时,先熄灭酒精灯,导致水槽中的水倒流进人了导气管,可采用的补救措施是__________________(答一种即可)。
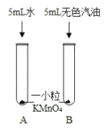
实验二、探究高锰酸钾的溶解性:小组同学设计了如图所示实验,请根据实验操作图示回答相关问题:
(1)步骤一:如图操作,振荡后静置,观察到:A试管中晶体全部溶解,溶液呈____色;B试管中晶体不溶解,汽油不变色;根据此实验可知影响物质溶解性的因素是__________。
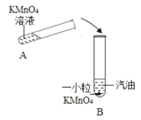
(2)步骤二:如图操作,将步骤一中A试管内溶液倒人B试管中,振荡后静置,观察现象。请你对B试管中出现的现象提出猜想并说明理由:________________________。
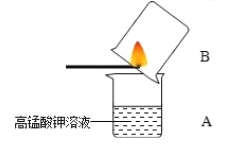
实验三、高锰酸钾溶液检验二氧化硫:如图所示,在小烧杯A中加入少量的稀高锰酸钾溶液。取一根小木条,在一头蘸一些硫粉,并点燃,迅速伸人烧杯B中,片刻后取出小木条,振荡烧杯A,可观察到烧杯A中出现的现象是 _____,该反应的化学方程式可表示为![]() ,其中X的化学式是_____,反应前后锰元素和硫元素化合价发生的变化分别是__________________。
,其中X的化学式是_____,反应前后锰元素和硫元素化合价发生的变化分别是__________________。
I拓展实验
实验过程中某同学的手上不小心沾上了高锰酸钾溶液,结果手上的皮肤变成了棕黄色,经过查阅资料结合已学过的化学知识分析原因,并在老师的指导下进行了如下拓展实验探究:
查阅资料:KMnO4溶液呈中性、有腐蚀性
讨论分析:构成皮肤细胞的基础物质是蛋白质,其属于_________(填“有机高分子化合物”或“碳水化合物”),遇到高锰酸钾溶液后被腐蚀,因此皮肤呈现棕黄色。进行如下两个实验探究KMnO4溶液对不同类物质的腐蚀性:
实验四、将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如表:
KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验五、将铜片分别浸泡在4种溶液中进行实验,浸泡相同时间,现象如下表:
编号 | ① | ② | ③ | ④ | |
实验 |
25mL0.1% KMnO4溶液 |
25mL0.1%KMnO4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO4溶液+10滴浓硫酸 | |
铜片质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |
解释与结论:
(1)实验四的目的是_______________________________;
(2)实验五中通过对比②和④,得出的结论是______________________________;
(3)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比______(填编号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某元素的原子结构示意图如图所示,下列说法不正确的是( )

A.该元素化学性质与第三层的电子数目密切相关
B.该元素是一种非金属元素
C.该元素原子的核外电子数为6
D.该元素原子在化学反应中易得到电子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定某AgNO3溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定。现取待测液50.0g,滴定过程如图所示。(计算结果均保留1位小数)
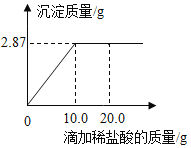
(1)当AgNO3与HCl恰好完全反应时,消耗7.3%的稀盐酸的质量为:____;
(2)当稀盐酸的质量滴加至20.0g时,溶液中的溶质为_____(写出化学式)
(3)计算AgNO3溶液的溶质质量分数_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com