
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )

A. 甲物质的溶解度大于乙物质的溶解度
B. t1℃时甲、乙两物质形成的饱和溶液中溶质质量分数相等
C. 当甲中含有少量的乙时,可以采用降温结晶的方法提纯甲
D. 将M点的甲溶液变为饱和溶液可采取升高温度的方法
【答案】BC
【解析】
根据溶解度的概念,溶解度曲线的应用进行分析解答。
A、在比较物质的溶解度时,需要指明温度,A选项中没有指明温度,故A错误;B、一定温度下饱和溶液的溶质分数=![]() ×100%,t1℃时,甲、乙两物质的溶解度相等,t1℃时甲、乙两物质形成的饱和溶液中溶质质量分数相等,故B正确;C、甲的溶解度随温度的升高而增大且受温度变化影响较大,当甲中含有少量的乙时,可以采用降温结晶的方法提纯甲,故C正确;D、甲的溶解度随温度的升高而增大,M点的甲溶液是t2℃时甲的不饱和溶液,升高温度不能将其转化为饱和溶液,将M点的甲溶液变为饱和溶液可采取降低温度或增加溶质的方法,故D错误。故选BC。
×100%,t1℃时,甲、乙两物质的溶解度相等,t1℃时甲、乙两物质形成的饱和溶液中溶质质量分数相等,故B正确;C、甲的溶解度随温度的升高而增大且受温度变化影响较大,当甲中含有少量的乙时,可以采用降温结晶的方法提纯甲,故C正确;D、甲的溶解度随温度的升高而增大,M点的甲溶液是t2℃时甲的不饱和溶液,升高温度不能将其转化为饱和溶液,将M点的甲溶液变为饱和溶液可采取降低温度或增加溶质的方法,故D错误。故选BC。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】随着经济的发展,能源和环境成为人们日益关注的问题.
(1)人类目前主要依赖的能源是化石燃料,包括煤、________、天然气.
(2)煤燃烧会产生大量的二氧化碳、一氧化碳和二氧化硫等气体,这些物质中会引起温室效应的是________, 会造成酸雨的是________,能与血红蛋白结合的是________.工业上常把煤块粉碎后使其充分燃烧,其目的是________.
A.减少煤的浪费 B.减少二氧化碳的排放 C.减少一氧化碳的排放 D.减少二氧化硫的排放
(3)化石燃料不可再生,开发和利用新能源迫在眉睫,氢能作为理想的能源,重要原因是它的燃烧产物无污染,用化学反应方程式表示为________.2mol氢气中约含 ________个氢原子(用科学计数法表示).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了研究可燃物的燃烧条件,某兴趣小组同学用如图所示装置进行实验(白磷、红磷均不超过绿豆大小,锥形瓶中的白磷A与红磷C尽量拉开距离),白磷的着火点为40℃,红磷的着火点为240℃。
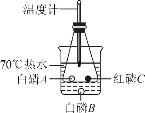
(1)写出锥形瓶中发生的实验现象:________________。
(2)结合本实验目的,写出烧杯中70℃热水的作用:_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,为检验镁条能否在N2中燃烧,某兴趣小组开展如下探究:
(查阅资料)氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;
(实验步骤)
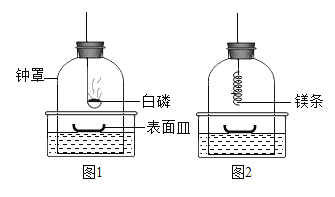
①将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
②待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
③打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
④待钟罩内水面不再变化时,观察钟罩内壁及表面皿中固体颜色,取少量固体加入水中。
(1)(分析)
a.步骤①中足量白磷在钟罩内燃烧的目的是________;
b.步骤③中镁条剧烈燃烧,反应的化学方程式为________;
c.步骤④中钟罩内壁及表面皿中出现淡黄色固体,加入水中,产生白色浑浊及能使湿润红色石蕊试纸变蓝色的气体,反应的化学方程式为________;
(2)(结论)镁能在N2中燃烧,并生成Mg3N2。
请你判断:2.40g镁条在某充满空气的密闭容器中完全燃烧,所得固体质量可能为________。
a.3.33g b.3.93g c.4.00g d.3.96g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】李明同学将浑浊的溪水样品倒入烧杯中,先加入明矾粉末来搅拌溶解,静置一会儿后,然后采用右图过滤装置来除去水中难溶性杂质。试回答:
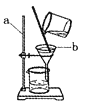
(1)写出标号仪器的名称:a______,b______。
(2)加入明矾的作用是_______, 实验过程中玻璃棒的作用是_____;
(3)过滤时,漏斗中的液面必须____(选“高于”或“低于”)滤纸边缘;
漏斗下端紧靠烧杯内壁是为了防止___。
(4)过滤后的水属于______(选填“纯净物”或“混合物”),理由是:____。
(5)过滤后发现滤液仍然浑浊,可能的原因是(答出一点即可) _____ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图(图中的微粒恰好完全反应)。请回答下列问题。

(1)丁的化学式为_____
(2)参加反应的甲、乙两物质的质量比为_____。(填最简整数比)
(3)由该图可知,分子和原子的本质区别是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室中有一种含有纯碱、小苏打和少量水的固体粉末样品。为了测定其中小苏打的含量,某化学兴趣小组的同学在老师的指导下,利用如图所示装置(部分固定装置已略去)进行实验。
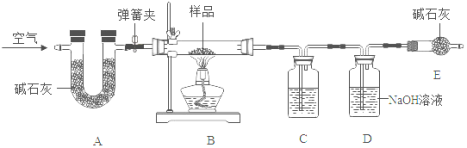
已知:①该装置气密性良好,A、C、D中所装药品足量且能完全吸收相关物质
②碱石灰是CaO与NaOH的固体混合物
③加热条件下,纯碱稳定不分解,小苏打易分解,反应的化学方程式为:2NaHCO3![]() NaCO3+H2O+CO2↑
NaCO3+H2O+CO2↑
探究过程如下:
Ⅰ.称量样品和已装入相关药品的装置C、D的质量,分别为:m、m1、m2;
Ⅱ.将质量为m的样品装入B玻璃管中,按图连接好装置,关闭弹簧夹,给玻璃管加热
Ⅲ.待玻璃管中样品完全反应,打开弹簧夹通空气,再熄灭酒精灯,直到玻璃管冷却
Ⅳ.再次称量装置C、D的质量,分别为m3、m4
请回答下列问题
(1)装置A中碱石灰的作用是_____
(2)装置C中所装药品为_____
(3)装置D中发生反应的化学方程式为_____
(4)装置E的作用_____
(5)依据实验所得数据计算,该样品中小苏打的质量分数为_____(用相关字母表示)。
(6)误差分析。按上述实验步骤测得该样品中小苏打的质量分数_____(填“偏大”“偏小”或“准确”),理由是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】味精的主要成分是谷氨酸钠,易溶于水,其化学式为C5H8NO4Na,与硝酸银溶液不反应。味精中还含有少量的氯化钠(味精中其他成分不考虑),氯化钠与硝酸银溶液发生复分解反应,生成氯化银白色沉淀。回答下列问题:
(1)称取5.0g味精配制成50g溶液,量取蒸馏水的量简规格是__________(填字母)。
A.10mL B. 50mL C.100mL
(2)下图是配制过程,正确的操作顺序为__________(填序号) 。
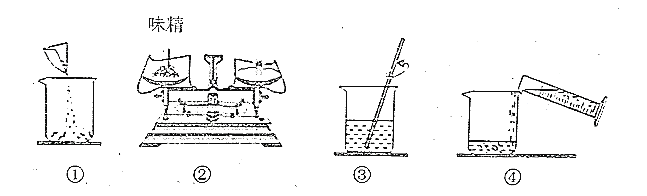
(3)在其他操作均正确的情况下,若配制过程中仰视读取蒸馏水的体积,则所配制溶液中谷氨酸钠的质量分数__________(填“偏大”“偏小”或“无影响”)。
(4)为测定味精中含有氯化钠的质量分数,继续实验:
①向所配制的50g溶液中加入过量的__________溶液(填化学式)充分反应。
②然后进行__________(填操作名称)、洗涤、干燥、称量白色沉淀固体。经精确测定白色沉淀的质量为2.87g,则该味精中氯化钠的质量分数为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”.其模拟流程如下:
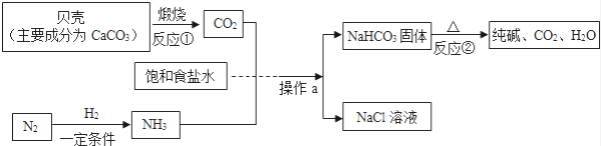
(1)反应①的化学方程式为________,反应②的基本反应类型为________.
(2)工业上用分离液态空气的方法制取氮气,属于________变化(填“物理”或“化学”).
(3)操作a的名称是________ , 实验室进行此操作时所需的玻璃仪器有烧杯、玻璃棒、________.
(4)写出NH4Cl的一种用途________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com