(2010?大连)某补钙剂的主要成分是碳酸钙.为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加入稀盐酸至不再产生气泡为止(其他成分不含钙元素,不溶于水也不与稀盐酸反应).过滤,得到滤渣2.5g,将滤液蒸干,得到氯化钙11.1g.计算:
(1)该补钙剂中碳酸钙的质量分数;
(2)某人除正常饮食之外,每天需补充0.64g钙元素,则每天需服用这种补钙剂多少克?
【答案】
分析:(1)根据补钙剂的主要成分是碳酸钙,而且其他成分不含钙元素、不溶于水也不与稀盐酸反应,可得知与稀盐酸反应至不再产生气泡时,所得滤渣为补钙剂中的杂质,并可由生成氯化钙的质量11.1g根据反应的化学方程式计算参加反应的碳酸钙的质量;该补钙剂中碳酸钙的质量分数=

×100%;
(2)由该补钙剂中碳酸钙的质量分数计算补钙剂中钙的质量分数,利用每天需补充钙元素的质量及补钙剂中钙元素的质量分数,计算每天需服用这种补钙剂的质量.
解答:解:(1)设补钙剂中碳酸钙的质量为x
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 111
x 11.1g
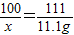
x=10g
该补钙剂中碳酸钙的质量分数=

×100%=80%
(2)该补钙剂中钙元素的质量分数=
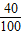
×100%×80%=32%
每天需服用这种补钙剂的质量=0.64g÷32%=2g
答:(1)该补钙剂中碳酸钙的质量分数80%;(2)每天需补充0.64g钙元素,则每天需服用这种补钙剂2克.
点评:若已知混合物中化合物的质量分数,混合物中某种元素的质量分数=化合物中该元素的质量分数×混合物中该化合物的质量分数.

 ×100%;
×100%;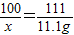
 ×100%=80%
×100%=80%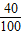 ×100%×80%=32%
×100%×80%=32%