
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.5g |
| 第二次加入5g | 1g |
| 第三次加入5g | 0.5g |
| 第四次加入5g | 0.3g |
| 1.7g |
| 2g |
| 100 |
| 0.5g |
| 73 |
| x |
| 0.365g |
| 5g |
| 16.1g |
| 1g.mL-1 |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:初中化学 来源: 题型:
 某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:
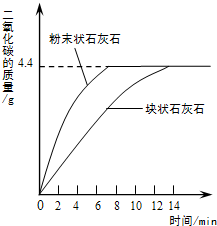 某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:
| 98 |
| x |
| 80 |
| 120g×10% |
| 98 |
| x |
| 80 |
| 120g×10% |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?乐山二模)某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状; ②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示:
(2012?乐山二模)某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状; ②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:
 某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com