
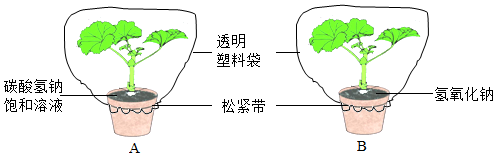
分析 该实验设计了以二氧化碳为变量的对照实验,目的是探究光合作用的原料是二氧化碳,实验中用氢氧化钠吸收B装置的二氧化碳,用碳酸氢钠为A装置提供二氧化碳.
解答 解:(1)为排除叶片内原有淀粉对实验结果的影响,实验前将实验装置放在黑暗处一昼夜,目的是将叶片内原有的淀粉运走耗尽.
(2)B盆中培养皿内放置氢氧化钠固体的作用是吸收实验装置中的二氧化碳,即氢氧化钠+二氧化碳→碳酸钠+水.
(4)小林同学设计的实验和小明的方法相比较优点是实验叶片来自同一植株,实验变量少,缺点是只用了两片叶,样本偏少,可能会使实验具有偶然性.
故答案为:(1)将叶片原有的淀粉运走耗尽;(2)2NaOH+CO2=Na2CO3+H2O;(4)④.
点评 设计实验方案时,设置单一变量是关键,该同学设置的实验充分注意了这个问题,设计合理、结论可靠.


科目:初中化学 来源: 题型:实验探究题
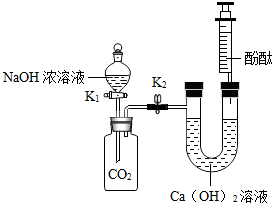 某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.
某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 |
| ①取滤液样品于试管中,加入足量的盐酸; | 若有气泡冒出,且红色消失 | 原废液中的溶质为: Na2CO3和NaOH; |
| ②另取滤液样品于试管中,加入Na2CO3溶液. | 若有白色沉淀出现,红色不消失 | 原废液中的溶质为: Ca(OH)2和NaOH. |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 工厂排放的废水:pH=4.3 | B. | 温瑞塘河水:pH=6.5 | ||
| C. | 瓯江水:pH=7.0 | D. | 楠溪江江水:pH=7.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
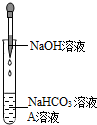 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 产生气泡 | Ⅰ | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com