
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入稀硫酸的质量/g | l0 | l0 | l0 | l0 | l0 |
| 剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
| 160 |
| 6.4g |
| 54 |
| x |
| 294 |
| y |
| 400 |
| z |
| 6.4g |
| 10g |
| 16g |
| 10% |
| 11.76g |
| 40g |
| 160 |
| 54 |
| 6.4g |
| x |


科目:初中化学 来源: 题型:
| A、溶液一定是无色、透明的混合物 |
| B、溶液加水稀释前后溶质的质量不变 |
| C、食盐水能导电是因为食盐水中含有较多自由移动的离子 |
| D、固体、液体、气体都能作溶质 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是实验室制取氢气的发生装置,在试管中下部安装了一个有孔塑料板,塑料板上放置锌粒,长颈漏斗中添加稀硫酸,胶管上放弹簧夹,该装置的优点是可以控制反应的发生和停止.打开弹簧夹时,酸液流下,浸没锌粒,反应发生,如果关闭弹簧夹,将看到的实验现象是
如图是实验室制取氢气的发生装置,在试管中下部安装了一个有孔塑料板,塑料板上放置锌粒,长颈漏斗中添加稀硫酸,胶管上放弹簧夹,该装置的优点是可以控制反应的发生和停止.打开弹簧夹时,酸液流下,浸没锌粒,反应发生,如果关闭弹簧夹,将看到的实验现象是查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
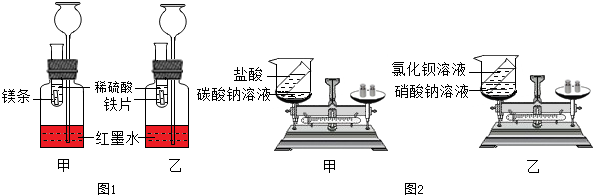
查看答案和解析>>
科目:初中化学 来源: 题型:
 工业上“侯氏”制碱法制得的纯碱(即碳酸钠Na2CO3)产品中常含有少量的氯化钠,工厂的化验员对每批产品进行检测,标出各种成份后才能投放市场.某厂化验员取取样品44g于烧杯中加水将其溶解,然后分几次逐滴加入溶质质量分数相同的稀盐酸,并不断搅拌,称量,将得到的有关数据记录如下:
工业上“侯氏”制碱法制得的纯碱(即碳酸钠Na2CO3)产品中常含有少量的氯化钠,工厂的化验员对每批产品进行检测,标出各种成份后才能投放市场.某厂化验员取取样品44g于烧杯中加水将其溶解,然后分几次逐滴加入溶质质量分数相同的稀盐酸,并不断搅拌,称量,将得到的有关数据记录如下:| 加入稀盐酸质量/g | 0 | 73 | 74 | 145 | 146 | 147 |
| 烧杯中溶液质量/g | 200 | 273 | 273.76 | 327.5 | 328.4 | 329.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
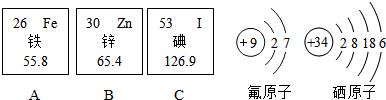
查看答案和解析>>
科目:初中化学 来源: 题型:
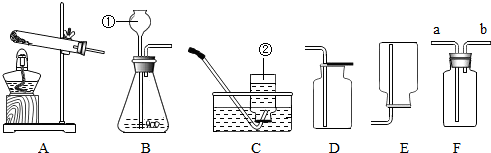
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com